почему опыт резерфорда проводился с золотой фольгой можно ли провести этот опыт с алюминием
Опыты Резерфорда по рассеянию альфа-частиц
Строение атома является сложным. Это подтверждают открытия таких явлений, как электрон, рентгеновские лучи и радиоактивность. В результате теоретических исследований и многочисленных опытов была построена теория строения атома. Особенно важный вклад в создание теории строения атома внёс английский физик Эрнест Резерфорд (1871 – 1937), который проводил опыты по изучению прохождения альфа-частиц через тонкие металлические пластины золота и платины.
Резерфорд в 1906 году предложил провести зондирование атомов тяжёлых элементов альфа-частиц с энергией 4,05 МэВ, которые испускались ядром урана или радия. Таким образом предлагалось изучить рассеяние (изменение направления движения) альфа-частиц в веществе.
Масса альфа-частицы примерно в 8000 раз больше массы электрона. Положительный заряд равен по модулю удвоенному заряду электрона 2е. Скорость альфа-частицы составляет 1/15 скорости света или 2 * 10 7 м/с. Альфа-частица – это полностью ионизированный атом гелия.
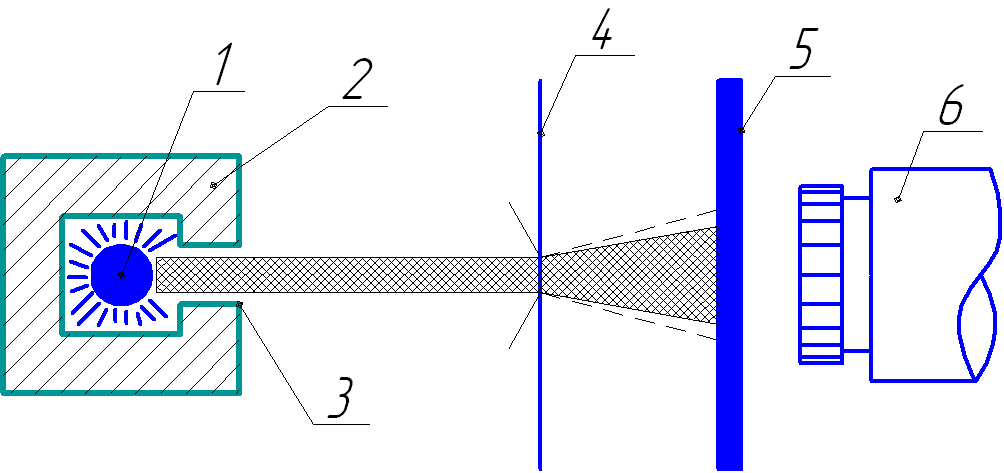
Упрощенная схема опытов Резерфорда изображена на рис. 1.1. Альфа-частицы испускались радиоактивным источником 1, помещённым внутри свинцового цилиндра 2 с узким каналом 3. Узкий пучок альфа-частиц из канала падал на фольгу 4 из исследуемого материала, перпендикулярно к поверхности фольги. Из свинцового цилиндра альфа-частицы проходили только через канал, а остальные поглощались свинцом. Прошедшие сквозь фольгу и рассеянные ею альфа-частицы попадали на полупрозрачный экран 5, который был покрыт люминесцирующим веществом (сульфатом цинка). Это вещество было способно светиться при ударе об него альфа-частицы. Столкновение каждой частицы с экраном сопровождалось вспышкой света. Эта вспышка называется сцинтилляция (от латинского scintillation – сверкание, кратковременная вспышка света). За экраном находился микроскоп 6. Чтобы не происходило дополнительного рассеяния альфа-частиц в воздухе, весь прибор размещался в сосуде с достаточным вакуумом.
Рис. 1.1. Упрощённая схема опытов Резерфорда.
В отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных тонким пучком альфа-частиц. Но когда на пути движения альфа-частиц помещали тонкую золотую фольгу толщиной примерно 0,1 мк (микрон), то наблюдаемая на экране картинка сильно менялась: отдельные вспышки появлялись не только за пределами прежнего кружка, но их можно было даже наблюдать с противоположной стороны золотой фольги.
Подсчитывая число сцинтилляций в единицу времени в разных местах экрана, можно установить распределение в пространстве рассеянных альфа-частиц. Число альфа-частиц быстро убывает с увеличением угла рассеяния.
Наблюдаемая на экране картина позволила заключить, что большинство альфа-частиц проходит сквозь золотую фольгу без заметного изменения направления их движения. Однако некоторые частицы отклонялись на большие углы от первоначального направления альфа-частиц (порядка 135 о …150 о ) и даже отбрасывались назад. Исследования показали, что при прохождении альфа-частиц сквозь фольгу примерно на каждые 10000 падающих частиц только одна отклоняется на угол более 10 о от первоначального направления движения. Лишь в виде редкого исключения одна из огромного числа альфа-частиц отклоняется от своего первоначального направления.
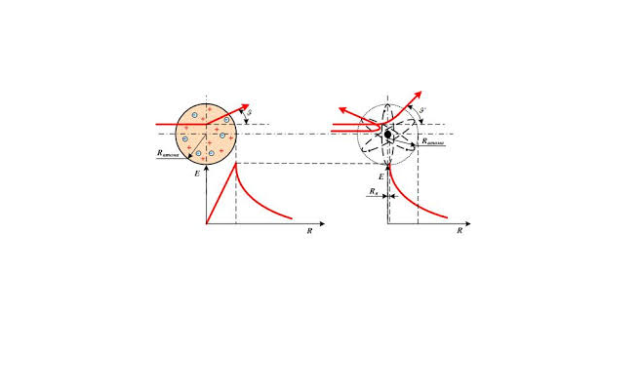
Тот факт, что многие альфа-частицы проходили сквозь фольгу, не отклоняясь от своего направления движения, говорит о том, что атом не является сплошным образованием. Так как масса альфа-частицы почти в 8000 раз превосходит массу электрона, то электроны, входящие в состав атомов фольги, не могут заметно изменить траекторию альфа-частиц. Рассеяние альфа-частиц может вызывать положительно заряженная частица атома – атомное ядро.
Атомное ядро – это тело малых размеров, в котором сконцентрированы почти вся масса и почти весь положительный заряд атома.
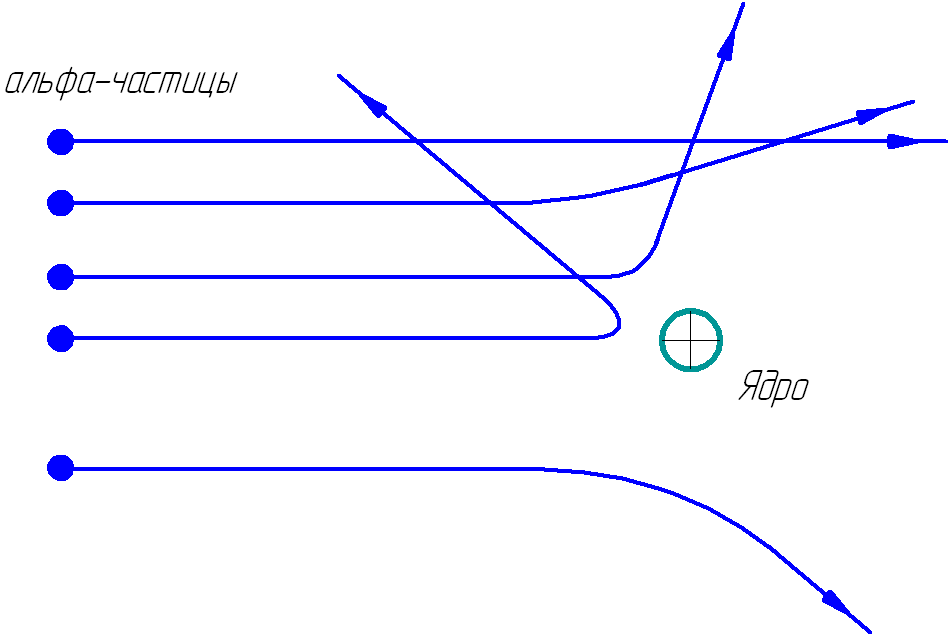
Чем ближе альфа-частица подходила к ядру, тем больше была сила электрического взаимодействия и тем на больший угол частица отклонялась. На малых расстояниях от ядра положительно-заряженная альфа-частица испытывает значительную силу отталкивания F от ядра, которую определяют по закону Кулона:
| F = | 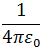 | • | 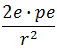 |
где r – расстояние от ядра до альфа-частицы; ε0 – электрическая постоянная в единицах измерения СИ; p – число протонов в ядре; е = 1,6*10-19 Кл – абсолютное значение элементарного электрического заряда (заряда электрона); 2e – заряд альфа-частицы
На рисунке 1.2 показаны траектории альфа-частиц, пролетающих на различных расстояниях от ядра.
Резерфорд смог ввести формулу, связывающую количество рассеянных на определённый угол альфа-частиц с энергией альфа-частиц и протонов р в ядре атома. Опытная проверка формулы подтвердила её справедливость и показала, что количество протонов в ядре равно числу внутриатомных электронов Z и определяется атомным номером химического элемента (то есть порядковым номером элемента в периодической системе Д.И.Менделеева):
Рис. 1.2. Траектории альфа-частиц.
Подсчитывая количество альфа-частиц, рассеянных на различные углы, Резерфорд смог оценить линейные размеры ядра. Чтобы положительное ядро могло отбросить альфа-частицу назад, потенциальная энергия электростатического (кулоновского) отталкивания у границ ядра атома должна равняться кинетической энергии альфа-частицы:
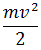 | = | 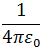 | • | 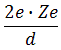 |
Оказалось, что ядро имеет диаметр:
Линейный диаметр самого атома:
Планетарная модель атома
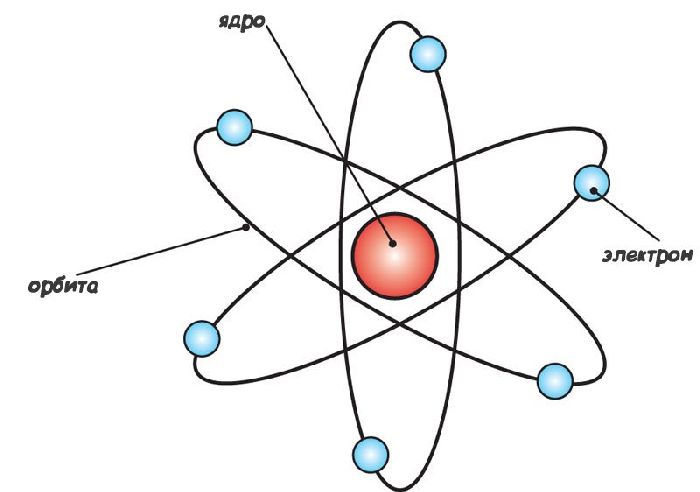
После анализа многочисленных опытов, Резерфордом в 1911 году была предложена планетарная модель атома (ядерная модель атома).
Согласно этой модели в центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Вокруг ядра вращаются по орбитам отрицательно заряженные электроны. Электроны движутся вокруг ядра на относительно больших расстояниях, подобно тому, как планеты вращаются вокруг солнца. Из совокупности этих электронов образуется электронная оболочка или электронное облако.
Атом в целом нейтрален, следовательно, абсолютное значение суммарного отрицательного заряда электронов равно положительному заряду ядра: число Z*e протонов в ядре равно числу электронов в электронном облаке и совпадает с порядковым номером (атомным номером) Z атома данного химического элемента в периодической системе Д.И.Менделеева.
Например, атом водорода имеет порядковый номер Z = 1, следовательно, атом водорода состоит из положительного ядра с зарядом, равным абсолютному значению заряда электрона. Вокруг ядра вращается один электрон. Ядро атома водорода названо протоном. Атом лития имеет порядковый номер Z = 3, следовательно, вокруг ядра атома лития вращаются 3 электрона.
Почему опыт резерфорда проводился с золотой фольгой можно ли провести этот опыт с алюминием
На основании исследований Фарадея можно было сделать вывод о существовании внутри атомов электрических зарядов.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д. И. Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились спектроскопические исследования, которые привели к открытию линейчатых спектров атомов. В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра. Впоследствии, в 1885 г. И. Бальмером были установлены математические закономерности, связывающие длины волн этих линий.
В 1896 году А. Беккерель обнаружил явление испускания атомами невидимых проникающих излучений, названное радиоактивностью. В последующие годы явление радиоактивности изучалось многими учеными (, П. Кюри, Э. Резерфорд и др.). Было обнаружено, что атомы радиоактивных веществ испускают три вида излучений различной физической природы (альфа-, бета- и гамма-лучи). Альфа-лучи оказались потоком ионов гелия, – потоком электронов, а гамма-лучи – потоком квантов жесткого рентгеновского излучения.
В 1897 году Дж. Томсон открыл электрон и измерил отношение заряда электрона к массе. Опыты Томсона подтвердили вывод о том, что электроны входят в состав атомов.
Таким образом, на основании всех известных к началу XX века экспериментальных фактов можно было сделать вывод о том, что атомы вещества имеют сложное внутреннее строение. Они представляют собой электронейтральные системы, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом.
Перед наукой встал вопрос о внутреннем строении атомов.
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Планетарная модель атома, предложенная Резерфордом, несомненно явилась крупным шагом вперед в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц, однако оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка ) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Опыт Резерфорда
Эрнест Резерфорд — уникальный ученый в том плане, что свои главные открытия он сделал уже после получения Нобелевской премии. В 1911 году ему удался эксперимент, который не только позволил ученым заглянуть вглубь атома и получить представление о его строении, но и стал образцом изящества и глубины замысла.
Используя естественный источник радиоактивного излучения, Резерфорд построил пушку, дававшую направленный и сфокусированный поток частиц. Пушка представляла собой свинцовый ящик с узкой прорезью, внутрь которого был помещен радиоактивный материал. Благодаря этому частицы (в данном случае альфа-частицы, состоящие из двух протонов и двух нейтронов), испускаемые радиоактивным веществом во всех направлениях, кроме одного, поглощались свинцовым экраном, и лишь через прорезь вылетал направленный пучок альфа-частиц. Далее на пути пучка стояло еще несколько свинцовых экранов с узкими прорезями, отсекавших частицы, отклоняющиеся от строго заданного направления. В результате к мишени подлетал идеально сфокусированный пучок альфа-частиц, а сама мишень представляла собой тончайший лист золотой фольги. В нее-то и ударял альфа-луч. После столкновения с атомами фольги альфа-частицы продолжали свой путь и попадали на люминесцентный экран, установленный позади мишени, на котором при попадании на него альфа-частиц регистрировались вспышки. По ним экспериментатор мог судить, в каком количестве и насколько альфа-частицы отклоняются от направления прямолинейного движения в результате столкновений с атомами фольги.
Эксперименты подобного рода проводились и раньше. Основная их идея состояла в том, чтобы по углам отклонения частиц накопить достаточно информации, по которой можно было бы сказать что-либо определенное о строении атома. В начале ХХ века ученые уже знали, что атом содержит отрицательно заряженные электроны. Однако преобладало представление, что атом представляет собой что-то похожее на положительно заряженную тонкую сетку, заполненную отрицательно заряженными электронами-изюминами, — модель так и называлась «модель сетки с изюмом». По результатам подобных опытов ученым удалось узнать некоторые свойства атомов — в частности, оценить порядок их геометрических размеров.
Резерфорд, однако, заметил, что никто из его предшественников даже не пробовал проверить экспериментально, не отклоняются ли некоторые альфа-частицы под очень большими углами. Модель сетки с изюмом просто не допускала существования в атоме столь плотных и тяжелых элементов структуры, что они могли бы отклонять быстрые альфа-частицы на значительные углы, поэтому никто и не озабочивался тем, чтобы проверить такую возможность. Резерфорд попросил одного из своих студентов переоборудовать установку таким образом, чтобы можно было наблюдать рассеяние альфа-частиц под большими углами отклонения, — просто для очистки совести, чтобы окончательно исключить такую возможность. В качестве детектора использовался экран с покрытием из сульфида натрия — материала, дающего флуоресцентную вспышку при попадании в него альфа-частицы. Каково же было удивление не только студента, непосредственно проводившего эксперимент, но и самого Резерфорда, когда выяснилось, что некоторые частицы отклоняются на углы вплоть до 180°!
В рамках устоявшейся модели атома полученный результат не мог быть истолкован: в сетке с изюмом попросту нет ничего такого, что могло бы отразить мощную, быструю и тяжелую альфа-частицу. Резерфорд вынужден был заключить, что в атоме большая часть массы сосредоточена в невероятно плотном веществе, расположенном в центре атома. А вся остальная часть атома оказывалась на много порядков менее плотной, нежели это представлялось раньше. Из поведения рассеянных альфа-частиц вытекало также, что в этих сверхплотных центрах атома, которые Резерфорд назвал ядрами, сосредоточен также и весь положительный электрический заряд атома, поскольку только силами электрического отталкивания может быть обусловлено рассеяние частиц под углами больше 90°.
Картина атома, нарисованная Резерфордом по результатам опыта, нам сегодня хорошо знакома. Атом состоит из сверхплотного, компактного ядра, несущего на себе положительный заряд, и отрицательно заряженных легких электронов вокруг него. Позже ученые подвели под эту картину надежную теоретическую базу (см. Атом Бора), но началось всё с простого эксперимента с маленьким образцом радиоактивного материала и куском золотой фольги.
Опыт Резерфорда. Постулаты Бора.
Цели и задачи урока:
Испускания и поглощения атомов. Опыт Резерфорда. Постулаты Бора.
К концу урока учащиеся смогут объяснить опыт Резерфорда, постулаты Бора.
Развитие умения мыслить, всех видов памяти, умение выделять главное, развитие видения логических связей внутри предмета, умение использовать полученные знания на практике.
Воспитание гармонически развитой, компетентной личности, формирование положительной самооценки личности, путем развития интереса к предмету и вовлечение каждого учащегося в учебную деятельность.
2. интерактивная доска
1. Организационный момент
2. Проверка изученного материала
3. Изучение нового материала
Ряд веществ, после облучения солнечным светом, светятся в темноте, такой вид излучения называют фотолюминесценцией. Французский физик Антуан Аини Беккерель, предполагал, что соли урана создают фотолюминесценцию, и изучал свойства этого излучения. Он обнаружил, что излучение солей урана подобно рентгеновскому излучению, оно способно засветить фотопластинку, обернутую в черной бумагу. В 1896 г. из-за облачной погоды ему не удалось провести опыт. Он положил бумагу и пластину вместе с солью урана в ящик стола. Благодаря счастливой случайности А. Беккерель сделал открытие. Он проявил пластину и увидел изображение креста, лежавшего поверх бумаги в том же ящике. Это означало: соли урана самопроизвольно, без каких либо внешних влияний создают излучение. Излучение было названо радиоактивным.
Самопроизвольное излучение атомов называют радиоактивностью.
В1911 г. английским физиком Э. Резерфордом был проведен опыт по рассеянию α-частиц золотой фольгой. К этому времени свойства α-частиц были изучены: они обладают положительным зарядом равным двум зарядам электрона q = 2|е|, масса примерно в 8000 раз больше массы электрона, скорость движения при испускании радием составляет около 20000 км/с.
С хема опыта показана на рисунке 137. Радий помещался в свинцовый контейнер с узким отверстием. Поток α-частиц после рассеяния на золотой фольге попадал на экран, покрытый сульфидом цинка.
При отсутствии золотой фольги на экране появлялось светящееся пятно, состоящее из вспышек, вызванных α-частицами (рис.138 а).
При размещении на пути пучка золотой фольги пятно расширялось, вокруг него наблюдались отдельные вспышки (рис.138 б).
Небольшое количество α-частиц было отброшено в обратном направлении.
Планетарная модель атома Резерфорда.
Планетарная модель позволяет объяснить многие явления природы, например: электризацию тел, хорошую проводимость металлов, но она не могла объяснить устойчивость атома. Электроны, излучая энергию, должны были упасть на ядро за ничтожно короткий промежуток времени. Модель атома Резерфорда не могла объяснить излучение разреженных газов, в спектре которых присутствует излучение строго определенных частот.
Для наблюдения спектра излучения газоразрядной трубки, наполненной разряженным газом, достаточно излучение направить на трехгранную призму. Как и в опыте Ньютона с солнечным лучом, свет разложится на составляющие и на экране появится спектр. Только в отличие от спектра солнечного луча на экране будут наблюдаться отдельные линии, разделенные темными полосами. Спектры различных газов отличаются по числу линий и по их цвету.
Спектр, в котором присутствуют все частоты видимого излучения, называют непрерывным или сплошным спектром.
Спектр, в котором присутствуют излучения частот определенного значения, называют линейчатым спектром.
Непрерывные спектры дают тела, находящиеся в твердом или жидком состоянии и сжатые газы. Линейчатые спектры дают все вещества в газообразном атомарном состоянии.
Линейчатые спектры поглощения.
Для наблюдения спектра поглощения атомов, через холодный газ пропускают излучение тел, спектр которых является сплошным. На фоне непрерывного спектра появляются темные линии.
Темные линии на фоне непрерывного спектра, соответствующие частотам поглощенного излучения, называют спектром поглощения.
Газ поглощает свет тех частот, которые он испускает в сильно нагретом состоянии.
Квантовые постулаты Бора.
В 1913 г. датский физик Нильс Бор сформулировал основные положения квантовой физики в виде постулатов.
В основу его постулатов легли планетарная модель атома Резерфорда и гипотеза Планка о квантах энергии излучения.
Первый постулат Бора:
Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия Еп; в стационарном состоянии атом не излучает.
Второй постулат Бора:
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ек в стационарное состояние с меньшей энергией Еп.
Энергия излученного фотона равна разности энергий стационарных состояний:
Частота излучения равна:
При поглощении энергии фотона электрон переходит из состояния с меньшей энергией в состояние с большой энергией.
Излучение и поглощение с точки зрения постулатов Бора.
П остулаты Бора и его модель атома со стационарными орбитами позволяют объяснить спектры излучения и поглощения света. На рисунке 139 изображен ряд энергетических уровней атома водорода, на которых может находиться электрон. При переходе электрона с верхнего уровня на нижний уровень энергия излучается. Частота излучения определяется разностью энергий электрона на этих уровнях. Переход на второй уровень с вышележащих четырех уровней называют серией Бальмера в честь швейцарского ученогоИоганна Якоба Бальмера, впервые наблюдавшего видимый спектр водорода. Чем больше разность энергий, тем больше энергия фотона, тем выше частота излучения.
С постулатами Бора стало понятным уменьшение мощности излучения абсолютно черного тела в области ультрафиолетовых волн сплошного спектра. В диапазоне ультрафиолетового излучения происходит ионизация атомов, электроны становятся свободными. Переходы на более низкие уровни, сопровождающиеся излучением, не наблюдаются.
1. Что называют радиоактивностью?
2. Какова модель атома Резерфорда?
3. Какой спектр называют сплошным, какой линейчатым?
4. Какой спектр называют спектром поглощения?
5. В чем заключаются постулаты Бора?
6. Почему в линейчатых спектрах излучения и поглощения линии для одного и того же элемента совпадают?
7. Почему весь положительный заряд атома Резерфорд расположил в его центре?
8. Почему в опыте по рассеянию α-частиц Резерфорд использовал золотую фольгу?
9. Почему большая часть α-частиц в опыте Резерфорда не изменила направление движения?
11. Для ионизации атома кислорода необходима энергия около 14 эВ. Найдите частоту излучения, которое может вызвать ионизацию.
б) домашнее задание: §33, упр. 33
Подготовьте сообщение (на выбор):
Роль спектрального анализа в изучении небесных тел.
Ученые, внесшие вклад в развитие атомной физики (на выбор: Й. Фраунгофер, Э. Резерфорд, И. Бальмер, Н. Бор, Ю. Ридберг).
Опыт Резерфорда

Всего получено оценок: 89.
Всего получено оценок: 89.
Важнейшим опытом, демонстрирующим сложное строение атома, стал опыт физика Э. Резерфорда. Рассмотрим суть этого опыта.
Опыт Резерфорда
Модель атома Томсона хорошо описывала явление испускания катодных лучей. Однако, она ничего не говорила о распределении заряда по атому. Для его изучения Э. Резерфорд предложил поставить специальный опыт.
Кратко об опыте Резерфорда можно сказать следующее.
Многие радиоактивные вещества испускают α-частицы, масса которых гораздо больше, чем масса электронов, а заряд равен удвоенному заряду электрона. Теперь, если облучать вещество α-частицами, то легкие электроны, входящие в состав атома, не смогут изменить направление их движения. Рассеяние α-частиц возможно лишь на положительно заряженной части атома.
Экспериментальная установка состояла из контейнера с радием, испускающим α-частицы, на пути частиц ставилась тонкая металлическая фольга, а за фольгой устанавливался экран, покрытый сульфидом цинка, на котором при попадании α-частиц возникало свечение (сцинтилляция). Схема опыта представлена на следующем рисунке:
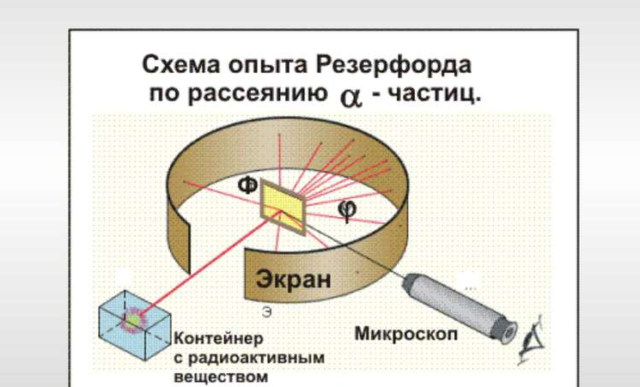
Без фольги, в точке облучения возникало сцинтилляционное пятно. Если на пути полета α-частиц поместить фольгу – размер пятна увеличится за счет рассеяния частиц из-за взаимодействия с положительными зарядами. По характеру изменения пятна можно судить о распределении положительного заряда в атомах вещества.
Результаты опыта
Если положительный заряд равномерно распределен по веществу, рассеяния α-частиц не будет. В соответствии с моделью атома Томсона, положительные заряды имеют некоторую пространственную неоднородность, а значит, рассеяние появится.
Рассеяние, действительно, появилось, но при этом имело довольно интересное распределение – некоторая часть частиц отклонялась на довольно заметные углы, иногда на большие, чем была рассчитана установка.
Это уже говорило о большой неравномерности распределения положительного заряда. Установка была модифицирована, экраны стали устанавливаться вокруг нее.
И с большим удивлением Резерфорд обнаружил, что небольшое число частиц (около 0,05%) отклоняются на очень большие углы, более 90⁰, некоторые – даже «отскакивали» от фольги в обратном направлении.
Для такого «отскока» потенциальная энергия электрического отталкивания должна быть равна кинетической энергии α-частицы:
В левой части этой формулы – потенциальная энергия взаимодействия, а в правой – кинетическая энергия частицы.
Опыт Резерфорда также позволяет оценить и заряд ядра. Он оказался разным для разных материалов, и если принять за единицу заряд электрона, то заряд ядра оказался равным порядковому номеру элемента в таблице Менделеева.
Если атом увеличить до размеров орбиты Земли, размер ядра окажется в сто раз меньше, чем размер Солнца.
Что мы узнали?
В опыте Э.Резерфорда по рассеянию альфа частиц поток частиц направлялся на тонкую фольгу, после которой на экране можно было видеть картину рассеяния. Оказалось, что некоторые частицы отклоняются на очень большие углы. Это говорило о том, что положительно заряженный заряд внутри атома сосредоточен в очень малой части атома, которая была названа ядром.