Миорелаксант деполяризующего действия рецепт
Миорелаксанты в анестезиологии
Миорелаксанты (мышечные релаксанты) — группа препаратов, применяемых в анестезиологии и реаниматологии для обеспечения миоплегии. Точкой приложения действия миорелаксантов является синаптическая область, в которой осуществляется нервно-мышечная передача. К современным миорелаксантам относятся: нимбекс, эсмерон, тракриум, мивакрон, ардуан и листенон. Ниже Вы найдете классификацию миорелаксантов, клиническое применение и побочные эффекты, а так же антагонисты миорелаксантов. История применения миорелаксантов в мировой практике здесь.
Классификация препаратов, используемых в анестезиологии (ингаляционные и внутривенные анестетики, бензодиазепины, вазопрессоры и кардиотоники) здесь.
Классификация миорелаксантов
Современная классификация миорелаксантов основана на механизме действия и продолжительности клинического эффекта.
Классификация миорелаксантов по длительности действия:
Классификация миорелаксантов по механизму действия (вариант прерывания рефлекторной дуги в нервно-мышечном синапсе):
Клиническое применение миорелаксантов в анестезиологии
Клиническое применение миорелаксантов в большей степени зависит от квалификации анестезиолога. В настоящее время, в общей хирургии предпочтение отдается миорелаксантам средней и короткой продолжительности действия, ввиду их высокой управляемости и предсказуемости клинического эффекта. Клиническое применение ардуана (миорелаксанта длительного действия) с каждым годом снижается.
Для интубации трахеи при тесте Mallampati I, II, III в плановой клинической ситуации применяются все выше перечисленные миорелаксанты. Однако, если прогнозируется технически сложная интубация трахеи (тест Mallampati IV) предпочтительнее использовать миорелаксант ультракороткого действия (листенон). Комбинация эсмерона и его селективного антагониста брайдан может заменить листенон.
Нимбекс
Нимбекс ( Nimbex; цисатракурия бесилат; cisatracurium besylate) — недеполяризующий миорелаксант средней продолжительности действия. После введения начальной дозы 0,1–0,15 мг/кг миоплегия наступает в течение 2–5 мин, интубация трахеи может быть выполнена на 2–3 минуте. Длительность клинического эффекта сохраняется 45–55 мин. Для поддержания миоплегии рекомендуются фракционное введение нимбекса 0,02–0,05 мг/кг или инфузионное 1–2 мкг/кг/мин. Повторные болюсные дозы нимбекса обеспечивают клинически эффективную миоплегию в течение 20–30 мин.
Важно отметить, что основная часть нимбекса (около 80%) подвергается спонтанной биодеградации по механизму саморазрушения неферментным путем (элиминация Хофманна), а 20% неизмененного миорелаксанта выводится с мочой.
Назначение нимбекса в диапазоне рекомендуемых доз характеризуется отсутствием влияния на систему кровообращения и выброс гистамина, что позволяет его использовать у пациентов с высоким анестезиологическим риском.
Эсмерон
Эсмерон (Esmeron; рокурония бромид; rocuronium bromide) — недеполяризующий миорелаксант средней продолжительности действия. После введения стандартной индукционной дозы 0,6 мг/кг комфортные условия для интубации трахеи возникают через 1 минуту, длительность действия при этом составляет 30–40 мин. При амбулаторных операциях короткой продолжительности в дозах 0,3–0,45 мг/кг рокурония бромид обеспечивает наступление миоплегии в течение 2 мин, а клиническая продолжительность составляет в среднем 14 и 20 мин соответственно. Увеличение индукционной дозы до 0,9–1 мг/кг позволяет выполнить интубацию трахеи в течение 45–60 с, однако это приводит к увеличению клинической продолжительности действия до 50–70 мин. Использование этого методического приема целесообразно лишь в тех случаях, когда предполагаемая продолжительность оперативного вмешательства превышает 40 мин. После назначения первоначальной дозы эсмерона дальнейшее поддержание миоплегии возможно путем дискретного введения препарата в дозе 0,15–0,3 мг/кг каждые 15–20 мин в зависимости от вида, длительности анестезии и операции. Инфузионная тактика использования эсмерона со скоростью 5–12 мкг/кг/мин оправдана при длительных оперативных вмешательствах.
У эсмерона самое быстрое время начала из всех недеполяризующих миорелаксантов, доступных в настоящее время. Максимальный эффект дозы 0,25–0,5 мг/кг в мышцах гортани развивается после 1,5 мин.
Тракриум
Тракриум (Tracrium; атракурия бесилат; atracurium besylate) — недеполяризующий миорелаксант средней продолжительности действия. Для интубации трахеи рекомендуемая доза составляет 0,5–0,6 мг/кг. Миоплегия возникает спустя 2–2,5 мин, при этом длительность клинического эффекта не превышает 30–35 мин. Дальнейшее поддержание миоплегии возможно с помощью дробных введений препарата в дозе 0,1–0,2 мг/кг каждые 15–30 мин или в виде инфузии со скоростью 5–9 мкг/кг/мин. Длительность восстановления не зависит от продолжительности инфузии или кратности введения тракриума. Глубина и продолжительность миоплегии могут увеличиваться при дыхательном и метаболическом ацидозе, гипотермии. Обратный эффект наблюдают при дыхательном и метаболическом алкалозе. Фармакокинетический профиль тракриума практически не изменяется при нарушении функции печени и почек, поэтому нет необходимости в коррекции дозы препарата у этой категории больных. Тракриум практически не оказывает прямого влияния на сердечно-сосудистую систему. Изменения показателей гемодинамики при использовании этого миорелаксанта обусловлены его гистаминогенными свойствами. Кроме того, гистаминолиберирующий эффект тракриума может вызвать бронхоспазм.
Очень важно, что элиминация тракриума осуществляется двумя путями: 45% спонтанная биодеградация Хофманна, часть препарата метаболизируется эстеразами легких. Почечная экскреция у пациентов без гепаторенальной патологии может достигать 40%.
Мивакрон
Мивакрон (Mivacron; мивакурия хлорид; mivacurium chloride) — недеполяризующий миорелаксант короткого действия. Рекомендуемые дозы для интубации трахеи у взрослых пациентов составляют 0,15–0,25 мг/кг. Клинический эффект развивается в течение 2–3 мин и длится 15–20 мин. Поддержание миоплегии в ходе анестезии осуществляют дробно по 0,05–0,1 мг/кг каждые 15 мин или инфузионно в дозе 3–15 мкг/кг/мин. Время достижения максимального эффекта зависит от дозы и возраста пациента и составляет: у взрослых 2–5 мин при введении 0,1–0,25 мг/кг, а у пациентов с печеночной и почечной недостаточностью 2–2,5 мин после введения 0,15 мг/кг, у пациентов старше 68 лет — 5 мин после введения 0,1 мг/кг. Клиническая длительность действия мивакрона в 2 раза меньше, чем у тракриума. Время восстановления нервно-мышечной проводимости в два раза меньше, чем у любого миорелаксанта средней продолжительности действия (нимбекс, эсмерон, тракриум), не зависит от дозы или продолжительности внутривенной инфузии. Повторное введение поддерживающих доз не приводит к развитию тахифилаксии. Побочные эффекты мивакрона, такие как гипотония, тахикардия, эритема, крапивница и бронхоспазм обусловлены его гистаминогенными свойствами.
Ардуан
Ардуан (Arduan; пипекурония бромид; pipecuronium bromide) — недеполяризующий миорелаксант длительного действия.
После введения начальной дозы ардуана 0,07–0,1 мг/кг интубация трахеи может быть выполнена через 3–4 мин. Для дальнейшего поддержания миорелаксации рекомендуется использовать дозы, составляющие 25–30% от первоначальной (0,01–0,015 мг/кг), что позволяет продолжить действие ардуана до 30–40 мин.
В настоящее время ардуан все реже используется в анестезиологической практике из-за сложной предсказуемости клинического эффекта и, как следствие, частой потребности в проведении декураризации на этапе пробуждения пациента.
Листенон
Листенон (суксаметония хлорид; lysthenon; suxamethonium chloride) — деполяризующий миорелаксант ультракороткого действия. После введения листенона в дозе 1–1,5 мг/кг комфортные условия для интубации трахеи у создаются в течение 1 минуты и продолжаются 4–6 мин.
Листенон используется редко в плановой анестезиологии, учитывая большое количество побочных эффектов, таких как гиперкалиемия, гиперсаливация, повышение внутрижелудочного давления, анафилактические реакции, послеоперационная миалгия, злокачественная гипертермия и др. Однако, листенон остается незаменимым в экстренной анестезиологии и реаниматологии.
Деполяризующие миорелаксанты
В
Схема 8. Фазный характер действия сукцинилхолина. Вначале сукцинилхолин вызывает длительную активацию рецептора, что вызывает открытие каналов и ток ионов натрия через мембрану с генерацией потенциала действия. Мембрана деполяризуется и становится невозбудимой (ФАЗА I). Постепенно закрываются инактивационные ворота натриевых каналов и, за счет выхода калия из мышечного волокна, возникает гиперполяризация мембраны. В этом состоянии возбуждение было бы возможно, но сукцинилхолин продолжает занимать активный центр рецептора и не позволяет ацетилхолину обеспечить генерацию потенциала (ФАЗА II).
Окончание действия сукцинилхолина связано с его гидролизом под влиянием холинэстеразы (основную роль в гидролизе играет псевдохолинэстераза).
ФК: Молекула сукцинилхолина содержит 2 четвертичных атома азота, поэтому он крайне плохо проникает через гистогематические барьеры, не поступает в ЦНС и для создания миорелаксации используется только в виде внутривенной инфузии или инъекции.
Метаболизм сукцинилхолина протекает в плазме крови за счет гидролиза псевдохолинэстеразой на 2 молекулы холина, ацетата и сукцинат. Скорость гидролиза не зависит от функции печени и почек, поэтому сукцинилхолин может применяться у пациентов с хроническими заболеваниями печени и почек.
ФЭ: Миопаралитическое действие сукцинилхолина развивается уже через 30-60 секунд после введения и сохраняется всего лишь 10-15 мин. Сразу после введенения может наблюдаться кратковременное подергивание (фасцикуляции) мышц, которые сменяются параличом. Но, при этом, характер развития паралича отличается от такового при введении антидеполяризующих миорелаксантов. Первыми выключаются мышцы шеи и конечностей, затем паралич захватывает мышцы лица, жевательные и глазодвигательные мышцы (однако, эти группы мышц никогда не парализуются полностью), мышцы глотки. В последнюю очередь выключается мускулатура туловища.
Респираторные мышцы чрезвычайно устойчивы к действию сукцинилхолина (его широта миопаралитического действия составляет 1:1.000) и блокируются только при использовании токсических доз лекарства.
Таблица 7. Сравнительная характеристика деполяризующего и антидеполяризущего блоков.
Деполяризующие миорелаксанты
В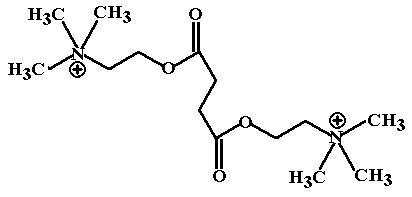
Схема 8. Фазный характер действия сукцинилхолина. Вначале сукцинилхолин вызывает длительную активацию рецептора, что вызывает открытие каналов и ток ионов натрия через мембрану с генерацией потенциала действия. Мембрана деполяризуется и становится невозбудимой (ФАЗА I). Постепенно закрываются инактивационные ворота натриевых каналов и, за счет выхода калия из мышечного волокна, возникает гиперполяризация мембраны. В этом состоянии возбуждение было бы возможно, но сукцинилхолин продолжает занимать активный центр рецептора и не позволяет ацетилхолину обеспечить генерацию потенциала (ФАЗА II).
Окончание действия сукцинилхолина связано с его гидролизом под влиянием холинэстеразы (основную роль в гидролизе играет псевдохолинэстераза).
ФК: Молекула сукцинилхолина содержит 2 четвертичных атома азота, поэтому он крайне плохо проникает через гистогематические барьеры, не поступает в ЦНС и для создания миорелаксации используется только в виде внутривенной инфузии или инъекции.
Метаболизм сукцинилхолина протекает в плазме крови за счет гидролиза псевдохолинэстеразой на 2 молекулы холина, ацетата и сукцинат. Скорость гидролиза не зависит от функции печени и почек, поэтому сукцинилхолин может применяться у пациентов с хроническими заболеваниями печени и почек.
ФЭ: Миопаралитическое действие сукцинилхолина развивается уже через 30-60 секунд после введения и сохраняется всего лишь 10-15 мин. Сразу после введенения может наблюдаться кратковременное подергивание (фасцикуляции) мышц, которые сменяются параличом. Но, при этом, характер развития паралича отличается от такового при введении антидеполяризующих миорелаксантов. Первыми выключаются мышцы шеи и конечностей, затем паралич захватывает мышцы лица, жевательные и глазодвигательные мышцы (однако, эти группы мышц никогда не парализуются полностью), мышцы глотки. В последнюю очередь выключается мускулатура туловища.
Респираторные мышцы чрезвычайно устойчивы к действию сукцинилхолина (его широта миопаралитического действия составляет 1:1.000) и блокируются только при использовании токсических доз лекарства.
Таблица 7. Сравнительная характеристика деполяризующего и антидеполяризущего блоков.
Миорелаксант деполяризующего действия рецепт
Нервно-мышечное соединение имеет большой коэффициент безопасности, и деполяризация концевой пластинки должна быть значительно уменьшена антидеполяризующими миорелаксантами до наступления истощения. В клинической практике мониторируют ответ в виде мышечного сокращения при воздействии четырьмя электрическими стимулами с частотой 2 Гц на конкретный нерв. Антидеполяризующие миорелаксанты уменьшают или блокируют эти сокращения. В абдоминальной хирургии при эффективной нервно-мышечной блокаде заметно только первое сокращение: последовательные стимулы вызывают прогрессирующее снижение количества высвобождаемого АХ и, соответственно, коэффициента безопасности.
По истечении эффекта миорелаксантов момент появления двух или более сокращений является индикатором того, что ингибирование ацетилхолинэстеразы противостоит блокаде. Ингибирование фермента позволяет достаточному количеству АХ накапливаться в синаптической щели и неоднократно взаимодействовать с рецепторами. Таким образом, откроется большее число каналов и восстановится нервно-мышечная передача. В случае избыточной антидеполяризующей блокады увеличение потенциала концевой пластинки из-за дезактивации ацетилхолинэстеразы не повлияет на восстановление передачи.
Важно понимать, что летучие анестетики и другие лекарственные средства тоже могут блокировать нервно-мышечную передачу, однако этот эффект не проявляется при введении клинических доз. Тем не менее они будут усиливать эффект антидеполяризующих миорелаксантов.
Действуя как аналог АХ, сукцинилхолин оказывает те же эффекты. Однако он разрушается не под действием ацетилхолинэстеразы, а медленно гидролизуется в плазме холинэстеразами. В результате сукцинилхолин сохраняется в синаптической щели в высоких концентрациях дольше, чем АХ. Вслед за длительной активацией нАХР сукцинилхолином поддерживается деполяризация концевой пластинки и десенситизация потенциал-зависимых натриевых каналов мембраны скелетной мышцы, и, следовательно, нейротрансмиссия отсутствует. Аналогичная нервно-мышечная блокада имеет место в эксперименте, когда блокируют ацетилхолинэстеразу и в концевую пластинку поступает большое количество АХ.
Основные отличия в молекулярном механизме действия двух групп миорелаксантов обусловливают характер их действия. Одним из основных отличий является то, что сукцинилхолин вызывает мышечные фасцикуляции — асинхронные сокращения всей двигательной единицы. Предполагают, что они становятся причиной устойчивой миалгии, длящейся довольно долго после операции. Одним из возможных механизмов считают стимуляцию множественно иннервируемых интрафузальных мышечных волокон, расположенных в рецепторах растяжения скелетных мышц. В результате рефлекторно активируются мотонейроны и соответствующие двигательные единицы. Другой возможный механизм основан на действии пресинаптических никотиновых рецепторов.
Можно отметить и то, что единственными множественно иннервируемыми мышцами в человеческом организме являются интрафузальные волокна и внеглазничные мышцы. Такая мышца отвечает ступенчатым сокращением на нарастание концентрации АХ или сукцинилхолина. Так, сукцинилхолин, вызывая ненужные и нескоординированные сокращения мышц глазного яблока, может усугубить глаукому.
Фасцикуляции по природе своего происхождения могут повредить мышцу и вследствие этого увеличить концентрацию натрия в сыворотке. Обычно это не имеет значения, за исключением больных с недавно полученными ожогами, спинальными травмами или миопатиями. У них значительное увеличение концентрации натрия может быть связано с денервацией поврежденной области и последующим образованием избыточного количества нАХР вне синапса, а рецепторы, активируясь, вызывают потерю натрия мышцами.
У некоторых людей (1 из 2000) имеется недостаток в плазме эстераз, разрушающих сукцинилхолин (недостаточность псевдохолинэстераз). В результате этого возникает продолжительная нервно-мышечная блокада. При полном отсутствии этих ферментов она может длиться несколько часов.
МИОРЕЛАКСАНТЫ
МИОРЕЛАКСАНТЫ (греч. mys, my[os] мышца + лат. relaxare ослаблять, смягчать; син. мышечные релаксанты) — лекарственные средства, уменьшающие тонус скелетных мышц и вызывающие в связи с этим снижение двигательной активности вплоть до полной обездвиженности.
Различают М. центрального и периферического типов действия.
К М. периферического действия относят курареподобные вещества (см.), к-рые вызывают релаксацию скелетных мышц за счет блокады нервно-мышечной передачи (см. Синапс). В соответствии с характером влияния на нервно-мышечную передачу среди препаратов этой группы выделяют вещества деполяризующего (дитилин и др.), не деполяризующего (тубокурарина диплацин, квалидил и др.) и смешанного (диоксоний и др.) типов действия. Кроме того, к М. периферического действия можно отнести фармакологически активные соединения, оказывающие прямое угнетающее влияние на тонус и сократимость скелетных мышц путем снижения выделения ионов Ca 2+ из саркоплазматического ретикулума мышечной ткани. В отличие от курареподобных средств такие соединения угнетают прямую возбудимость скелетных мышц и не влияют на нервно-мышечную передачу. Т. о., эти вещества можно рассматривать как периферические М. прямого миотропного действия.
К М. центрального действия относят так наз. мианезиноподобные (мефенезиноподобные) вещества, к-рые по своим свойствам и механизму мышечно-расслабляющего действия близки к мианезину (мефенезину) — первому препарату этой группы, внедренному в мед. практику. По хим. структуре М. центрального действия можно разделить на следующие группы: 1) производные пропандиола — мианезин, мепротан (см.), изопротан (см.) и др.; 2) производные оксазолидина — метаксолон, хлорзоаксазон; 3) бензодиазепины — диазепам (см.), хлордиазепоксид (см.) и др.; 4) препараты разного хим. строения — орфенадрин и др. Свойствами М. центрального действия обладает также мидокалм.
В эксперименте М. центрального действия уменьшают спонтанную двигательную активность животных и снижают мышечный тонус. В очень высоких дозах они вызывают вялый паралич скелетной мускулатуры и апноэ, обусловленное релаксацией дыхательных мышц. В субпаралитических дозах М. центрального действия устраняют у животных явления децеребрационной ригидности и гиперрефлексии, ослабляют судороги, вызываемые стрихнином и электрическим током. Кроме того, большинство М. центрального действия обладает седативными, а нек-рые препараты (напр., бензодиазепины, мепротан) транквилизирующими свойствами и способностью потенцировать действие снотворных и анальгетических средств.
В отличие от М. периферического действия центральные М. даже в сублетальных дозах практически не влияют на нервно-мышечную передачу или прямую возбудимость скелетных мышц. Механизм мышечнорасслабляющего действия препаратов этой группы обусловлен их угнетающим влиянием на синаптическую передачу возбуждения в ц. н. с. Общим свойством центральных М. является способность подавлять активность вставочных нейронов полисинаптических рефлекторных путей спинного мозга и нек-рых вышележащих отделов ц. н. с. В связи с этим М. центрального действия активно угнетают полисинаптические рефлексы и существенно не влияют на моносинаптические рефлексы. Определенное значение в механизме действия центральных М. имеет также угнетение нисходящих тормозных и облегчающих влияний со стороны ряда надсегментарных структур (ретикулярная формация, подкорковые ядра) на двигательные центры спинного мозга.
М. используют в различных областях мед. практики в целях снижения тонуса скелетной мускулатуры. При этом выбор препаратов для той или иной цели осуществляется с учетом широты их миопаралитического действия. Так, подавляющее большинство курареподобных веществ деполяризующего, не деполяризующего и смешанного типов действия, имеющих малую широту миопаралитического действия, используют в целях тотальной миорелаксации гл. обр. в анестезиологии, а также при лечении столбняка и для профилактики травматических осложнений при проведении электросудорожной терапии.
Центральные М., дантролен и курареподобные средства из числа третичных аминов — мелликтин (см.) и др.— имеют большую широту миопаралитического действия, что позволяет использовать их в целях снижения мышечного тонуса без угнетения или выключения спонтанного дыхания. Такие препараты используют при заболеваниях, сопровождающихся патол, повышением тонуса скелетных мышц. В неврол, практике, напр., их применяют при спастических состояниях различного происхождения (церебральные и спинномозговые параличи, болезнь Литтла, спастическая кривошея и др.). М. центрального действия применяют также при мышечных контрактурах травматического или воспалительного (напр., при ревматических заболеваниях) происхождения. Применение препаратов данной группы при указанной патологии способствует не только уменьшению болевых ощущений в мышцах пораженной области (вследствие снижения тонуса мышц), но и позволяет более эффективно осуществлять реабилитацию больных, т. к. устранение контрактур облегчает проведение леч. физкультуры. В анестезиол, практике М. центрального действия и дантролен используют относительно реже, чем курареподобные вещества, и применяют по иным показаниям.
Побочное влияние М. центрального действия и дантролена проявляется гл. обр. слабостью, сонливостью, головокружением, диспептическими расстройствами. Возможно появление аллергических реакций. Указанные препараты не следует назначать во время работы лицам, профессия к-рых требует точных и быстрых психических и двигательных реакций (водители транспорта и др.).
Применение миорелакеантов в анестезиологии
В анестезиологии для достижения глубокой мышечной релаксации при проведении оперативных вмешательств, нек-рых диагностических процедур и искусственной вентиляции легких используют препараты из группы курареподобных веществ. В зависимости от предполагаемой продолжительности оперативного вмешательства или диагностической процедуры выбор отдельных курареподобных препаратов производят с учетом длительности их действия. Так, для кратковременной (в течение нескольких минут) миорелаксации (при интубации трахеи, вправлении вывихов, репозиции костных отломков, кратковременных операциях и диагностических процедурах) целесообразно использовать курареподобные препараты короткого действия, напр, дитилин (см.), тубокурарин (см.), анатруксоний (см.), павулон и др.; препараты с большой продолжительностью действия применяют гл. обр. для поддержания длительной миорелаксации в течение операций под наркозом с управляемым дыханием, при искусственной вентиляции легких, сложных и продолжительных диагностических процедурах. Дитилин для достижения длительной миорелаксации может быть использован только при условии его введения фракционным способом или методом капельной инфузии. При помощи курареподобных препаратов можно вызвать тотальную или частичную блокаду нервно-мышечной передачи. К тотальной блокаде прибегают во время длительных операций, требующих глубокой миорелаксации и выполняемых, как правило, в условиях эндотрахеальной общей анестезии (см. Ингаляционный наркоз).
В случаях, когда не требуется тотальной миорелаксации. но в ходе операции может понадобиться расслабление мышц определенной части тела (живота, конечностей), осуществляют частичную блокаду скелетной мускулатуры введением малых доз курареподобных препаратов. Наиболее удобны для этой цели препараты не деполяризующего типа действия.
В связи с сохранением спонтанного дыхания оперативные вмешательства в этом случае могут быть выполнены под масочным наркозом при условии тщательного наблюдения за состоянием газообмена и готовности компенсировать ею нарушения вспомогательной или искусственной вентиляцией легких (см. Искусственное дыхание). Методика проведения тотальной миорелаксации при наркозе, проводимом при помощи специальных масок (см. Маска для наркоза) без интубации трахеи, широкого распространения не получила.
При комбинированном применении курареподобных препаратов следует помнить, что введение обычной дозы недеполяризующих веществ (напр., тубокурарина) после неоднократных инъекций дитилина вызывает более глубокий и продолжительный нервно-мышечный блок, чем в обычных условиях. Многократное введение дитилина после применения недеполяризующих препаратов в обычных дозах вслед за кратковременным антагонизмом приводит к углублению нервно-мышечного блока конкурентного типа и затягиванию периода восстановления мышечного тонуса и дыхания. Для оценки характера нервно-мышечной блокады, вызываемой курареподобными препаратами, может быть использован метод электромиографии (см.). Электромиографически недеполяризационный нервно-мышечный блок характеризуется постепенным снижением амплитуды потенциала действия мышцы без предшествующего облегчения нервно-мышечной передачи и мышечных фасцикуляций, выраженным пессимумом частоты раздражения и феноменом посттетанического облегчения. Для деполяризационного (двухфазного) нервно-мышечного блока характерно преходящее облегчение нервно-мышечной передачи, сопровождающееся мышечными фасцикуляциями, и быстрое последующее развитие нервно-мышечного блока. В первой фазе амплитуда одиночного потенциала действия мышцы снижена, тетанус устойчив, феномен посттетанического облегчения отсутствует. Во второй фазе выявляются более или менее выраженные пессимум частоты раздражения и феномен посттетанического облегчения нервно-мышечной передачи. Электромиографические признаки второй фазы отмечаются уже при первом введении дитилина и диоксония, а с увеличением числа инъекций выраженность и устойчивость этих признаков возрастают.
Применение курареподобных препаратов при миастении представляет особую проблему. Больные миастенией (см.) чрезвычайно чувствительны к препаратам деполяризующего типа. Введение им стандартной дозы дитилина приводит к развитию двухфазного нервно-мышечного блока с ярко выраженными признаками второй фазы, в связи с чем повторные инъекции препарата могут привести к чрезмерно длительной и глубокой миорелаксации, нарушению восстановления дыхания и мышечного тонуса. При оперативном лечении миастении получила распространение методика аутокураризации, заключающаяся в снижении дозы или отмене антихолинэстеразных средств перед операцией, использовании минимальной дозы дитилина при интубации и проведении гипервентиляции во время операции, что позволяет избежать повторных введений этого препарата или ограничиться минимальными его дозами.
Абсолютных противопоказаний к применению курареподобных средств нет, однако при нек-рых заболеваниях могут быть противопоказаны отдельные препараты данной группы. Поэтому большое значение имеет рациональный и обоснованный выбор курареподобных препаратов с учетом характера основного и сопутствующих заболеваний. Так, у больных с почечной недостаточностью, нарушениями водно-электролитного равновесия, ацидозом, гипопротеинемией отмечается повышенная чувствительность к М. из группы курареподобных веществ недеполяризующего типа действия (тубокурарин и др.), а также к курареподобным препаратам смешанного типа действия (диоксонию и др.) в связи с нарушением распределения и элиминации этих препаратов. Частой причиной необычно длительного действия дитилина является снижение активности псевдохолинэстеразы — фермента, осуществляющего гидролиз этого препарата (при генетических дефектах фермента, заболеваниях печени, злокачественных новообразованиях, хрон, нагноительных процессах, кровотечениях, истощении). Нежелательно применять дитилин во время глазных операций и у больных с повышенным внутричерепным давлением в связи с его способностью повышать внутриглазное и внутричерепное давление. Применение дитилина опасно также у лиц с обширными ожогами, параплегией, длительной иммобилизацией.
Осложнения при применении курареподобных средств в значительной степени обусловливаются нерациональным выбором препаратов для данного больного, а также применением препаратов без учета характера их взаимодействия между собой и с препаратами из других групп лекарственных средств. Наиболее частым осложнением при применении курареподобных средств в анестезиологии является продленное апноэ — необычно длительное угнетение дыхания и мышечного тонуса после использования средней дозы препарата. После введения препаратов конкурентного типа, а также диоксония продленное апноэ может развиться у больных с почечной недостаточностью, ацидозом, нарушениями водно-электролитного равновесия, гиповолемией и в результате потенцирующего влияния нек-рых препаратов (общих и местных анестетиков, ганглиоблокаторов, хинидина, дифенина, бета-адреноблокаторов). Неоднократные инъекции дитилина, предшествующие введению тубокурарина, также могут способствовать развитию продленного апноэ. Миопа-ралитическое действие дитилина отчетливо потенцируют антихолинэстеразные средства, пропанидид, аминазин, цитостатики (циклофосфан, сарколизин), трасилол. Кроме того, причиной замедленного восстановления дыхания и мышечного тонуса после применения дитилина могут явиться гиперкапния (см.) и дыхательный ацидоз (см.). Для декураризации широко используют антихолинэстеразные средства (прозерин, галантамин и др.), блокирующие холинэстеразу и способствующие тем самым накоплению ацетилхолина в нервно-мышечных синапсах, что приводит к облегчению нервно-мышечной передачи, нормализации дыхания и мышечного тонуса. Возможно также применение средств, увеличивающих синтез и выделение ацетилхолина в нервно-мышечных синапсах (джермин, пимадин и менее эффективные гидрокортизон, пантотенат кальция).
Грозным, хотя и сравнительно редким осложнением, связанным с применением курареподобных веществ, является рекураризация. Под рекураризацией понимают углубление остаточной миорелаксации вплоть до апноэ или резкого угнетения дыхания, к-рое развивается, как правило, в первые два часа после операции под влиянием ряда факторов, нарушающих распределение, метаболизм и элиминацию препаратов. К таким факторам относятся дыхательный и метаболический ацидоз, нарушения водно-электролитного равновесия, гиповолемия, артериальная гипотония, воздействие нек-рых препаратов (антибиотиков из группы аминогликозидов, хинидина, трасилола, циклофосфана), неадекватная декураризация антихолинэстеразными средствами в конце операции.
После введения дитилина и, в меньшей степени, диоксония происходит освобождение заметных количеств калия из скелетных мышц во внеклеточную жидкость, в результате чего нередко развивается преходящая брадикардия, реже — атриовентрикулярный блок, очень редко — асистолия (последние два осложнения описаны только после применения дитилина).
Тубокурарин и квалидил обладают способностью освобождать гистамин, в связи с чем отмечается преходящая тахикардия, не требующая обычно специального лечения. К редким осложнениям, связанным с применением тубокурарина и других курареподобных веществ недеполяризующего действия, относится так наз. прозериноустойчивая кураризации. Обычно причиной неэффективности антихолинэстеразных средств, примененных с целью декураризации, является их введение на фоне очень глубокой блокады нервно-мышечной передачи либо на фоне метаболического ацидоза. Описаны случаи прозериноустойчивой кураризации после применения средней дозы тубокурарина на фоне неоднократного предварительного введения дитилина.
Лечение осложнений: обеспечение адекватной искусственной вентиляции легких вплоть до восстановления нормального мышечного тонуса и устранение причины осложнения.
В анестезиологии М. используют и по другим показаниям. Так, М. центрального действия, обладающие выраженным транквилизирующим действием, напр, диазепам, мепротан, можно использовать в качестве средств для премедикации перед наркозом (см.). Мидокалм применяют при проведении электроанестезии (см.). Диазепам в комбинации с наркотическим анальгетиком фентанилом применяют для целей так наз. атаралгезии (сбалансированной анестезии) при проведении нек-рых оперативных вмешательств. Кроме того, М. центрального действия иногда используют для подавления мышечной дрожи и снижения теплопродукции при гипертермическом синдроме (см.). Способностью купировать проявления этого синдрома, возникающего иногда после применения ингаляционных анестетиков (напр., фторотана) и дитилина, обладает также дантролен.
Библиография: Харкевич Д. А. Фармакология курареподобных средств, М., 1969; The pharmacological basis of therapeutics, ed. by L. S. Goodman a. A. Gilman, p. 239, N. Y. a. o., 1975; Physiological pharmacology, ed. by W. S. Root a. F. G. Hoffmann, v. 2, p. 2, N. Y.—L., 1965; PinderR.M. a. o. Dantrolene sodium, a review of its pharmacological properties and therapeutic efficacy in spasticity, Drugs, v. 13, p. 3, 1977.
В. К. Муратов; В. Ю. Словентантор, Я. М. Хмелевский (анест ).