после лечения хламидиоза когда можно беременеть
Половые инфекции и бесплодие
ИППП и ЗППП – пожалуй, две самые пикантные медицинские аббревиатуры. Это синонимы – инфекции, или заболевания, передающиеся половым путем. Многие очень стесняются обсуждать эти «болезни от любви» даже с близкими людьми и медицинскими работниками. У многих они вызывают лишь смешки и становятся темами для анекдотов. На самом деле ничего смешного здесь нет. Помимо неприятных симптомов, ЗППП, особенно если их долго не лечить, могут вызывать серьезные осложнения, например, мужское и женское бесплодие.
По официальной статистике, ежегодно российские врачи выявляют у жителей нашей страны почти 250 000 случаев ИППП. И это только то, что удалось диагностировать. Далеко не всем удобно рассказывать о такой деликатной проблеме даже докторам. Некоторые надеются вылечиться самостоятельно антибиотиками, о которых узнали из литературы или интернета. А некоторые практически не испытывают симптомов и даже не знают, что больны. Они продолжают менять половых партнеров и «делиться» с ними возбудителями.
Половые инфекции – одна из самых распространенных причин бесплодия у женщин и мужчин. Этим болезням, как и любви, все возрасты покорны, но чаще всего заражаются люди 20–30 лет, то есть те, кто находятся на пике своих репродуктивных возможностей.
По данным экспертов Всемирной Организации Здравоохранения (ВОЗ), во время полового контакта партнеры могут «поделиться» друг с другом тридцатью разными видами бактерий, вирусов и паразитов. Восемь из них вызывают наиболее распространенные ЗППП, среди которых: гонорея, сифилис, трихомониаз, хламидиоз, герпес, папиллома, ВИЧ-инфекция и вирусный гепатит B.
Как ИППП приводят к бесплодию?
Некоторые механизмы хорошо известны, другие пока еще предстоит изучить. В 15–30% случаев причины бесплодия остаются неизвестными: возможно, в будущем часть из них будет также отнесена на счет инфекций.
В норме, после того как созревшая яйцеклетка покинула яичник, она должна попасть в полость матки по маточной трубе. Некоторые половые инфекции, такие как урогенитальный хламидиоз, уреаплазмоз и гонорея, приводят к воспалению, из-за которого в маточных трубах образуются рубцы, и они становятся непроходимыми. Нарушаются сокращения мышц в их стенках, с помощью которых они помогают яйцеклетке продвигаться.
Некоторые микроорганизмы нарушают подвижность сперматозоидов в женских половых путях, провоцируют выработку антиспермальных антител. Например, микоплазмы могут прикрепляться к головке или средней части сперматозоидов, тем самым мешая их движению.
У мужчин возбудители ИППП поражают мочеиспускательный канал, яички и их придатки, предстательную железу, семенные пузырьки, семявыносящие протоки. Работа этих органов нарушается, уменьшается количество спермы вплоть до полного отсутствия, снижается ее качество.
Риски бесплодия особенно высоки, когда инфекция протекает длительно, переходит в хроническую форму. Это может произойти по разным причинам:
Хламидиоз – одна из самых распространенных инфекций, передающихся половым путем. У многих людей она протекает бессимптомно. У женщин заболевание может проявляться в виде выделений из влагалища, болей в низу живота, болезненности во время половых контактов, жжения во время мочеиспускания, кровянистых выделений в промежутках между месячными. Бесплодие возникает из-за нарушения проходимости маточных труб, также есть риск внематочной беременности. Кроме того, хламидии могут повреждать слизистую оболочку маточных труб.
У мужчин хламидийная инфекция может проявляться в виде выделений из пениса, дискомфорта во время мочеиспусканий, припухлости и болезненности яичек. При этом снижается качество спермы.
Гонорея проявляется похожими симптомами – они возникают чаще, чем при хламидиозе и обычно выражены ярче. Характерное проявление у мужчин – болезненные мочеиспускания и выделения гноя. Из-за гонококков также нарушается проходимость маточных труб, снижается качество спермы.
Микоплазмоз у женщин, так же, как гонорея и хламидиоз, может приводить к воспалению матки и ее придатков, бесплодию.
Генитальный герпес – одна из самых распространенных TORCH-инфекций – проявляется в виде болезненных воспаленных пузырьков в области половых органов и жжения во время мочеиспусканий. Эта инфекция опасна тем, что она неизлечима. Есть лекарства, которые помогают избавиться от симптомов, но вирус сохраняется в организме и может приводить к новым обострениям, в том числе во время беременности. Зараженная женщина способна забеременеть, но если во время беременности инфекция обострится, это может привести к необратимым последствиям для плода. Если у матери есть симптомы заболевания, рекомендуется кесарево сечение, чтобы малыш не проходил через родовые пути, в которых находится вирус.
ВИЧ-инфекция снижает фертильность, но все же многие больные женщины могут забеременеть. Проблема в том, что инфекция неизлечима и может передаваться ребенку во время беременности, грудного вскармливания. Врачи лишь могут снизить этот риск с помощью некоторых мер, но стопроцентно гарантировать, что ребенок не заразится, невозможно: ВИЧ-инфекция – высококонтагиозное (очень заразное) заболевание.
Сифилис приводит к выкидышам и мертворождениям. Если беременная женщина больна, ребенок появляется на свет с врожденной формой инфекции, это приводит к серьезным осложнениям.
Можно ли забеременеть, если было ЗППП?
Некоторые половые инфекции, такие как хламидиоз и гонорея, успешно лечатся антибиотиками. Важно начать лечение как можно раньше, пока возбудители не успели распространиться на органы таза, и пока инфекция не привела к осложнениям, так как они зачастую не лечатся даже после уничтожения инфекционного агента. Нужно добросовестно выполнять назначения врача, не прекращать курс раньше времени, даже если симптомы уменьшились. После лечения нужно повторно сдать анализы, убедиться, что инфекция ликвидирована, и только после этого планировать беременность.
Если у одного из партнеров выявлено ЗППП, второму тоже нужно провериться! Учитывая, что ИППП могут протекать бессимптомно, стоит сдать анализы на этапе планирования беременности, даже если вас ничего не беспокоит!
Если у женщины обнаружено трубное бесплодие из-за рубцов, их придется устранять хирургически. Выполняют лапароскопические операции.
В случае с вирусными ИППП, от которых нельзя излечиться, зачастую врач, после того как оценит риски, сможет принять меры, чтобы минимизировать вероятность заражения ребенка. Такие ситуации нужно обсуждать с акушерами-гинекологами индивидуально.
Как защититься от заражения?
ЗППП вполне можно предотвратить. Меры просты, и они хорошо известны каждому. К сожалению, не все их соблюдают:
Тем не менее, от этого не застрахован никто. Помимо половых инфекций, в течение жизни женщина может столкнуться со многими факторами, способными повлиять на ее фертильность. Сюда относятся вредные привычки, профессиональные вредности, частые стрессы, гинекологические заболевания, прием некоторых лекарственных препаратов. Все эти факторы накладываются на естественное снижение репродуктивной функции.
Если вы не спешите заводить детей и планируете беременность после 35 лет, вы можете застраховать свое репродуктивное здоровье. Репробанк предлагает вам сохранить ваши половые клетки в криохранилище. В замороженном состоянии они смогут храниться долгие годы. Это дает вам возможность забеременеть в будущем и родить здорового, полноценного ребенка. Свяжитесь с нами, чтобы узнать подробности.
Актуальные проблемы лечения беременных с рецидивирующей хламидийной инфекцией
Специфические инфекционные заболевания полового тракта у беременных значительно увеличивают частоту материнских и перинатальных осложнений. Такая инфекция, как хламидиоз, ассоциированная с микоплазмами, цитомегаловирусная, герпесвирусная инфекции, а такж
Специфические инфекционные заболевания полового тракта у беременных значительно увеличивают частоту материнских и перинатальных осложнений. Такая инфекция, как хламидиоз, ассоциированная с микоплазмами, цитомегаловирусная, герпесвирусная инфекции, а также их сочетание с бактериальными поражениями являются одной из ведущих причин перинатальной смертности (Королева А. И., 2000; Стрижаков А. Н. и соавт., 2003). В последние годы возросло число хламидийной, вирусной, микоплазменной и смешанной инфекций, борьба с которыми представляет значительные сложности в связи с развивающейся устойчивостью микроорганизмов к антибиотикам и особенностями ответных реакций организма (Глазкова Л. К., 1999; Рюмин Д. В., 1999; Семенов В. М., 2000; Хрянин А. А., 2001; Johnson R. A., 2000).
По-прежнему высокой остается частота урогенитального хламидиоза у беременных, колеблющаяся от 3% до 74% по данным различных авторов (Асцатурова О. Р., 2001; Прилепская В. Н. и соавт., 1998; Семенов В. М., 2000; Hiltunen-Back E., 2001; Stamm W. E., 1999).
В настоящее время доказано, что Chlamydia trachomatis является облигатным паразитом человека. Заражение происходит при половом контакте, редко — бытовым путем (Плиева З. А., 2000; Morion R. S., Kinghom G. R., 1999).
Хламидийная инфекция ведет к прерыванию беременности, невынашиванию, развитию фетоплацентарной недостаточности, внутриутробному инфицированию (ВУИ) плода, послеродовым воспалительным заболеваниям, неонатальным инфекциям.
В I триместре беременности наиболее характерным осложнением является угрожающий выкидыш, неразвивающаяся беременность и спонтанный аборт. Во II и III триместрах угроза прерывания беременности имеет длительное течение, а токолитическая терапия дает, как правило, нестойкий эффект. Это связано с инфицированием амниона хламидиями, которое встречается у 65% беременных. Тельца Chlamydia trachomatis выявлены во всех тканевых структурах плаценты женщин с генитальным хламидиозом. Отмечено, что пораженные хламидиями клетки обнаружены в просвете капилляров ворсин хориона, что указывает на возможный гематогенный путь передачи инфекции от матери к плоду. В плацентах женщин с генитальным хламидиозом происходит нарушение иммунного гомеостаза с образованием патогенных иммунных комплексов (ПИК), включающих IgM, IgG, IgA и фиксирующих С3-фракцию комплемента как маркер патогенности. Показано, что фиксация ПИК на мембранных структурах плаценты приводит к разрушению мембран синцития и плацентарного барьера. Последнее вызывает развитие плацентарной недостаточности и повреждение фето-плацентарной системы.
В случаях инфицирования амниотических оболочек может развиться многоводие, специфическое поражение плаценты (плацентит), плацентарная недостаточность, гипотрофия и гипоксия плода. Истинные пороки развития плода не являются патогномоничными для хламидийной инфекции.
В процессе эхографического обследования беременных с внутриутробным инфицированием достоверно чаще встречаются следующие эхографические признаки: многоводие, маловодие, гиперэхогенная взвесь в околоплодных водах, изменения плаценты. При проведении ультразвуковой плацентографии у женщин с инфекционной патологией гениталий обнаруживаются следующие изменения: утолщение плаценты, разнородная эхогенность паренхимы плаценты, преждевременное «старение» плаценты, расширение межворсинчатых пространств, расширение субхориального пространства, утолщение/удвоение контура базальной пластинки. В 75% имеется сочетание двух или нескольких вариантов изменения эхографической структуры плаценты.
Следует отметить, что при наличии более двух эхографических маркеров у новорожденного в 82% наблюдений постнатально диагностируется внутриутробная инфекция.
Для беременных с хламидийной инфекцией и фетоплацентарной недостаточностью первичными ее проявлениями являются нарушения внутриплацентарного кровотока.
Механизмы ВУИ при хламидийной инфекции включают следующие пути распространения инфекции:
При отсутствии гипоксии плода и аспирации инфицированного содержимого родового канала риск развития тяжелой инфекции у новорожденного ниже, чем при длительном контакте плода с инфицированной средой во время беременности. Так, почти половина новорожденных от матерей с хламидиозом имеют клинически выраженную инфекцию.
К неонатальным проявлениям хламидийной инфекции относятся поражения кожи и слизистых (конъюнктивит), пневмония, отит, вульвит, уретрит. У недоношенных детей возможно развитие специфического миокардита после хламидийной пневмонии, описаны случаи хламидийного менингита и энцефалита.
В зависимости от пути заражения и инфицирующей дозы, проявления перинатальной хламидийной инфекции могут встречаться не только в первые 168 ч жизни новорожденного (ранний неонатальный период), но и реализовываться в течение первых месяцев жизни ребенка.
Основным методом борьбы с подобными осложнениями является своевременное проведение рациональной этиотропной антибиотикотерапии.
Пациенткам с бактериальными ИППП чаще всего назначают системную терапию антибактериальными препаратами с учетом предполагаемой или определяемой чувствительности возбудителя.
Общими положениями являются преимущественное использование макролидов как препаратов выбора для лечения хламидийной, микоплазменной и уреаплазменной инфекций у беременных, начало лечения после 20 нед гестации или в III триместре беременности.
Для лечения урогенитального хламидиоза в гинекологической практике используют тетрациклины, фторхинолоны и макролиды. Применение тетрациклинов и фторхинолонов во время беременности и лактации противопоказано из-за наличия неблагоприятных эффектов для эмбриона, плода и новорожденного.
Для лечения беременных с генитальными инфекциями применяются такие антибиотики группы макролидов, как эритромицин, спиромицин и джозамицин, использование которых с учетом срока гестации безопасно для матери и плода.
Одним из наиболее изученных с точки зрения безопасности у беременных является макролидный антибиотик джозамицин (Вильпрафен). Важное клиническое значение имеет его высокая активность против таких внутриклеточных патогенов, как C. trachomatis, M. hominis, M. genitalium, U. Ureallyticum. Джозамицин быстро и полностью всасывается из желудочно-кишечного тракта (ЖКТ), создавая максимальную концентрацию в плазме крови уже через 1 ч. Важным аспектом, определяющим успех лечения, является достижение высоких концентраций препарата в тканях по сравнению с плазмой крови. Способность джозамицина накапливаться преимущественно в фагоцитирующих клетках особенно важна для элиминации внутриклеточных возбудителей. Доказано, что фагоциты доставляют джозамицин в места локализации инфекционного агента, где действующее вещество освобождается в процессе фагоцитоза, причем концентрация джозамицина в очаге инфекции на 30% выше, чем в здоровых тканях. В отличие от ряда препаратов данного класса джозамицин не стимулирует двигательную функцию кишечника и не ингибирует такие важнейшие компоненты метаболической системы печени, как цитохром Р 450 и НАДФ-цитохром С-редуктазу. Таким образом, джозамицин отличают оптимальный спектр активности в отношении урогенитальных патогенов, благоприятная фармакокинетика и высокая безопасность, в том числе у беременных.
Следует отметить, что в настоящее время бактериостатический антибиотик эритромицин практически не используется для лечения урогенитального хламидиоза, так как его микробиологическая эффективность зачастую не превышает 30% (Асцатурова О. Р. и соавт., 2001; Страчунский Л. С., 1998; Ridgway G. L., 1995).
С целью выявления частоты генитальных инфекций, факторов риска их развития, приводящих к осложнениям беременности, родов и их исходов для новорожденного, было проведено обследование 5430 беременных на базе родильного дома и консультативно-диагностического центра при ГКБ № 7 с 1997 по 2005 г.
Контрольную группу составили 200 женщин с отсутствием генитальных инфекций в анамнезе и во время беременности, у детей которых не были диагностированы инфекционно-воспалительные заболевания в раннем неонатальном периоде.
Частота встречаемости заболеваний, передаваемых половым путем, составила 17,85% (969). Структура ИППП у беременных была представлена хламидийной (24,56%), микоплазменной (8,36%), уреаплазменной (3,1%), трихомонадной (4,85%), смешанной (59,13%) инфекциями.
Острые и обострения хронических вирусных заболеваний наблюдались в 10,24% (556 случаев) и были представлены герпетическими поражениями в 8,34%, цитомегаловирусной инфекцией — в 0,78% и папилломавирусной инфекцией — в 1,12%.
Высокая частота смешанных инфекций при хламидиозе, наличие малосимптомного и латентного его течения приводит к необходимости комплексной диагностики ИППП и нарушений микроценоза влагалища.
Ни один из современных методов диагностики хламидиоза не обеспечивает 100% надежности. Поэтому лабораторная диагностика должна основываться на сочетании минимум двух методов, одним из которых должен являться метод полимеразной цепной реакции (ПЦР).
Непосредственная идентификация элементарных телец (ЭТ) и ретикулярных телец (РТ) хламидий возможна при микроскопии мазков, окрашенных по Романовскому–Гимзе. Цитоплазматические включения определяются в виде микроколоний, окрашенных в темно-синий или розовый цвет (тельца Гальберштадтера–Провачека). Чувствительность цитологического метода обнаружения хламидий не превышает 10–12%. Метод позволяет оценить состояние микроценоза влагалища, количество лейкоцитов, выявить наличие дрожжеподобных грибов, влагалищных трихомонад.
Наиболее распространенный метод диагностики хламидийной инфекции — иммуноцитологический — основан на реакции прямой или непрямой иммунофлюоресценции (определение антигена С. trachomatis).
При его использовании к биологическому материалу добавляются меченые флюоресцинами моноклональные антитела. Полученные мазки оценивают под люминесцентным микроскопом. Чувствительность метода колеблется в пределах 65–90%, а специфичность — 85–90%. Главными недостатками метода являются его субъективность и низкая чувствительность.
Иммуноферментный анализ основан на идентификации антигенов хламидий путем связывания их антителами. Количественная оценка комплексов антиген-антитело проводится с помощью автоматизированного определения выраженности цветной реакции. Преимуществом метода является возможность определять растворимые антигены, время проведения (4–6 ч), недостатком — возможность получения ложноотрицательных и ложноположительных реакций.
ПЦР обладает преимуществами по сравнению с иммунологическими методами: высокая специфичность — 95%; максимальная чувствительность; быстрота проведения (4–5 ч). Недостатком ПЦР-диагностики хламидиоза является то, что метод амплификации ДНК не позволяет оценить жизнеспособность клетки, дает положительные результаты при малых количествах возбудителя и наличии отдельных фрагментов его генома. Несмотря на это первичным способом оценки элиминации хламидий должна являться ПЦР. При получении положительного результата показано проведение микробиологического исследования, а при невозможности последнего — повторная ПЦР через 5–6 нед.
Наиболее достоверным методом диагностики хламидиоза является сочетание культурального исследования и ПЦР.
К методам непрямой диагностики хламидийной инфекции относится определение уровня специфических антител. Накопление антител классов М, G и А происходит через разные промежутки времени и зависит от характера инфицирования (первичная инфекция, реинфекция). При первичном инфицировании вначале появляются IgM, затем — G, потом — А. При вторичном инфицировании отмечается быстрое нарастание антител классов G и А на фоне отсутствия IgM. Этот метод исследования позволяет определить стадию заболевания, оценить эффективность проводимого лечения, доказать хламидийную этиологию экстрагенитальных поражений.
Определение ДНК Chlamidia trachomatis проводили путем ПЦР. Материалами для исследований служили соскоб из цервикального канала, со слизистых, слюна, моча и кровь новорожденных. Все соскобы забирали с использованием одноразовых стерильных цитологических щеточек фирмы PathFinder (США). Использовали многоканальный амплификатор ДНК «Терцик™» и наборы реактивов к нему (АО «Петровакс», Институт иммунологии, Москва).
У 238 беременных острая хламидийная инфекция (длительность заболевания менее 2 мес) имелась у 79 (33,19%), хроническая (более 2 мес) — у 159 (66,8%). У большинства пациенток с хронической инфекцией (62%) имелись анамнестические данные, свидетельствующие о длительности заболевания более полугода и неадекватной предшествующей терапии.
Под нашим наблюдением в ходе проспективной части исследования находились 72 беременные со сроком гестации 29–41 нед, у 33 (45,83%) из которых предшествующая этиологическая терапия острой или хронической хламидийной инфекции была неэффективна, а также 28 (38,89%) женщин с хронической рецидивирующей инфекцией и 11 (15,28%) беременных, преждевременно прекративших ранее начатую терапию. До включения в исследование больные получали различную антибиотикотерапию: в первой подгруппе 16 (57,14%) беременных по поводу хламидийной инфекции принимали эритромицин по 1–3 г/сут, 9 — азитромицин по 0,25 г/сут, 8 — спирамицин по 9 млн ЕД/сут. Необходимо отметить неадекватность суточной дозы эритромицина и азитромицина для лечения хламидиоза.
Интересным представляется факт, что 9 из 11 беременных, прекративших начатое лечение самостоятельно (81%), получали эритромицин и спирамицин. При целенаправленном расспросе в ходе настоящего исследования удалось выяснить, что они мотивировали отказ от терапии «опасностью для ребенка» при приеме «таких высоких доз» антибиотика.
Всем пациенткам после разъяснения особенностей течения хламидийной инфекции, ее опасности для беременной и плода, необходимости проведения антибактериальной терапии и лечения, направленного на купирование осложнений беременности, действия препарата джозамицина (Вильпрафен) и схемы его применения была назначена терапия, включавшая прием 1 таблетки (500 мг) Вильпрафена 3 раза/сут на протяжении 10 дней. Всем половым партнерам больных проводилось обследование и лечение генитальных инфекций. После терапии Вильпрафеном беременные в течение 3-х дней фиксировали возможные побочные эффекты препарата (тошнота, рвота, боль в животе, изменение характера стула, метеоризм, сыпь, кожный зуд).
Контроль за эффективностью терапии осуществляли на основании результатов ПЦР через 4 нед после приема Вильпрафена. Лечение считали эффективным при отсутствии обнаружения генома Chlamydia trachomatis. При положительных результатах первой ПЦР выполняли культуральное исследование (или ПЦР через 5–6 нед).
Микробиологическая эффективность применения джозамицина у беременных с хламидийной инфекцией по результатам первого контрольного обследования составила 93,06%. В трех наблюдениях при положительных результатах первой ПЦР не обнаружено роста C. trachomatis на культуре клеток McCoy. В течение 3 мес наблюдения микробиологически верифицированная персистенция хламидий после лечения сохранялась у 2 женщин (2,78%).
По сравнению с данными, полученными в контрольной группе, при хламидиозе имеются значимые отличия в частоте акушерско-гинекологической патологии во время беременности (рис. 1).
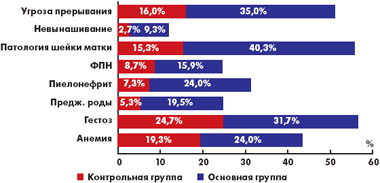 |
| Рис. 1. Осложнения беременности у женщин контрольной группы и с хламидийной инфекцией |
Осложнениями гестационного процесса, связанными с хламидийной инфекцией, считали угрозу прерывания беременности, преждевременные роды, фетоплацентарную недостаточность и задержку роста плода, эхографические маркеры внутриутробного инфицирования (изменение эхогенности плаценты, много- и маловодие, структурные дефекты развития плода). Кроме того, отмечена высокая частота сочетания хламидиоза с патологией шейки матки и инфекцией мочевыводящих путей.
После проведения лечения Вильпрафеном по указанной схеме (1500 мг/сут в течение 10 дней) зарегистрировано существенное снижение частоты осложнений беременности, родов, общей и инфекционной заболеваемости новорожденных (рис. 2).
 |
| Рис. 2. Частота осложнений беременности, родов и неонатальной заболеваемости после лечения хламидиоза Вильпрафеном |
Применение Вильпрафена для лечения урогенитального хламидиоза во время беременности, в том числе после неэффективной терапии другими антибиотиками, приводит к микробиологической излеченности у 97,22% пациенток. Важно отметить, что такие высокие показатели эффективности лечения достигнуты в группе женщин с рецидивирующей и хронической хламидийной инфекцией. Кроме того, применение джозамицина возможно вне зависимости от срока беременности.
Не было зарегистрировано отказов от рекомендованного лечения. Нежелательные явления на фоне приема Вильпрафена в виде тошноты отметили 2 беременные и в виде «тяжести» в животе — 1 женщина (всего 4,17%).
Особенностью хронической хламидийной инфекции является скудная симптоматика или полное отсутствие клинических проявлений заболевания, что приводит к поздней диагностике. В то же время нерациональная антибиотикотерапия не только обусловливает возникновение резистентности возбудителя, но и приводит к позднему началу адекватного лечения. Высокая частота ассоциированных с инфекцией осложнений требует проведения высокоинформативных методов диагностики хламидиоза и назначение этиотропной терапии в комплексном лечении беременных.
Частота перинатальных инфекций после использования Вильпрафена во время беременности снизилась в 2,4 раза. Не было отмечено случаев хламидийной пневмонии и генерализованной инфекции у новорожденных, матери которых получали терапию джозамицином.
Таким образом, у беременных с ИППП эхографические маркеры инфекции обнаруживаются почти в 30%. Частота фетоплацентарной недостаточности у этих женщин возрастает почти в 2 раза. Гемодинамические нарушения у беременных с восходящим инфицированием плода преимущественно регистрируются в плодово-плацентарном звене кровообращения.
Так как хроническая и рецидивирующая хламидийная инфекция приводит к изменениям фетоплацентарного комплекса, необходимо своевременно диагностировать хламидийные поражения и осуществлять комплексную терапию с учетом степени распространения процесса, срока беременности и наличия сопутствующих осложнений.
Лечение хламидийной инфекции у беременных с помощью джозамицина (Вильпрафена) уменьшает частоту материнских и перинатальных осложнений, имеет хорошую переносимость, обладает высоким удобством для соблюдения режима приема и психологического комфорта пациенток.
По вопросам литературы обращайтесь в редакцию.
П. В. Буданов, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва


