предельные одноатомные спирты можно распознать с помощью
Предельные одноатомные спирты можно распознать с помощью
Органическая химия
Качественные реакции в органической химии
Качественные реакции на алканы
Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
Качественные реакции на алкены
а) Обесцвечивание перманганата калия (реакция Вагнера).
СН2=СН2 + [О] 
б) Обесцвечивание бромной воды:
Качественные реакции на алкины
а) Обесцвечивание перманганата калия (реакция Вагнера).
б) Обесцвечивание бромной воды:
в) Взаимодействие с с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса)
Получившийся ацетиленид серебра (I) выпадает в осадок.
Алкины, у которых тройная связь в середине (R-C≡C-R) в эту реакцию не вступают.
Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогащается электронной плотностью и протон становится подвижным.
Качественные реакции на альдегиды
а) Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала)
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
б) Взаимодействие с гидроксидом меди (II) (реакция медного зеркала)
Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
в) Взаимодействие с раствором фуксинсернистой кислоты.
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных спиртов реакции различны.
а) Окисление спирта оксидом меди.
Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
б) Взаимодействие с натрием.
Качественные реакции на многоатомные спирты
а) Взаимодействие с гидроксидом меди (II).
В отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания.
К примеру, при приливании глицерина образуется глицерат меди (II) ( хелатный комплекс темно-синего цвета):
Химия. 10 класс
Конспект урока
Урок № 6. Одноатомные предельные спирты
Перечень вопросов, рассматриваемых в теме
Урок посвящён изучению состава, структуры и химических свойств спиртов, способов их получения и применения. Рассмотрено влияние метанола и этанола на организм человека
Алканолы – класс предельных одноатомных спиртов.
Алкоголяты – производные спиртов и металлов.
Водородная связь образуется между атомами водорода одной молекулы и атомами очень электроотрицательных элементов другой молекулы. (F,O,N,Cl). Водородная связь – это особый вид межмолекулярной связи, которая слабее обычной ковалентной связи в 10-20 раз, но она оказывает большое влияние на физические свойства соединений.
Дегидратация – реакция, идущая с отщеплением молекул воды от органических соединений.
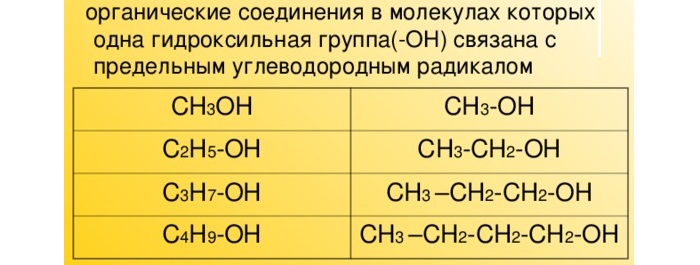
Спирты – производные предельных углеводородов, в которых один или несколько атомов водорода замещен на гидроксогруппу.
Этерификация – реакция образования сложных эфиров из спиртов и кислот.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу (-ОН).
Спирты – в зависимости от углеводородного заместителя – подразделяются на предельные, непредельные и ароматические.
Общая формула предельных одноатомных спиртов CnH2n+1-ОН
Гидроксильная группа – главная особенность строения спиртов, определяющая их свойства. Спирты подразделяются по числу гидроксильных групп на одноатомные, двухатомные, трёхатомные и многоатомные.
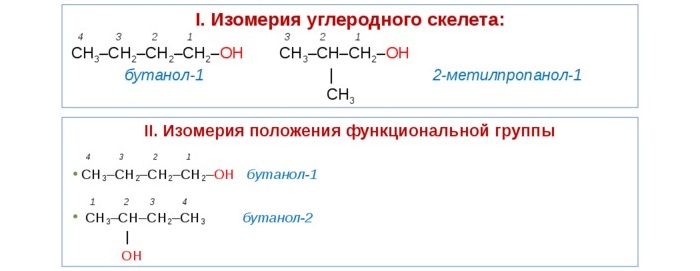
Для спиртов характерно несколько видов изомерии:
а) изомерия углеродного скелета, б) изомерия положения группы –ОН,
2. межклассовая изомерия
Сильное влияние на физические свойства спиртов оказывает водородная связь, образующаяся между молекулами спиртов.
Два следствия водородной связи: 1) хорошая растворимость веществ в воде; 2) повышение температуры плавления и кипения. С увеличением молекулярной массы растворимость спиртов в воде уменьшается.
Группа ОН – функциональная группа, которая определяет наиболее характерные свойства вещества и его принадлежность к определённому классу соединений.
Для спиртов характерны реакции замещения и дегидратации.
Атом углерода, соединённый с гидроксогруппой может замещаться на аммиак, хлорид- или бромид-ион.
В присутствии некоторых катализаторов спирты подвергаются дегидратации с образованием алкенов.
Спирты проявляют слабые кислотные и основные свойства. Как кислоты спирты реагируют с щелочами и сильными основаниями, как основания – с сильными кислотами.
Спирты распространены в природе. В частности, этанол является продуктом брожения плодов, содержащих углеводы, под действием дрожжей. В листьях и стеблях растений содержатся некоторые другие спирты.
В промышленности спирты получают методом гидратации из алкенов. Метанол получают реакцией между водородом и угарным газом.
Спирт – это и лекарственное средство, имеющее дезинфицирующее и антибактериальное действие. 60-70 %-ный раствор оказывает угнетающее действие на микроорганизмы, разрушая их частично или полностью убивая. Если концентрация раствора выше 20 %, он вызывает обезвоживание и свертывание белковых веществ клетки.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1.Запишем уравнения реакций:
2.Рассчитаем количества вещества спирта:
N(CH3OH) = 3,2г/32г/моль=0,1 моль.
3.Определяем количество вещества метилата натрия:
4. Определяем массу метилата натрия:
m (CH3ONa)=0,1 моль х 54г/моль=5,4 г.
Спирты
Классификация спиртов
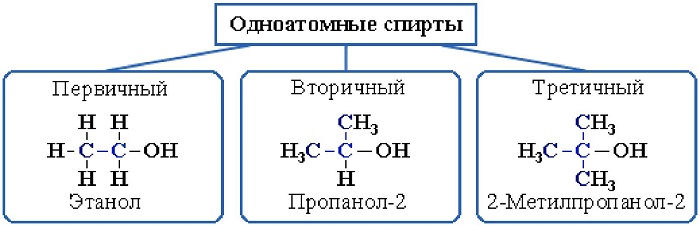
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
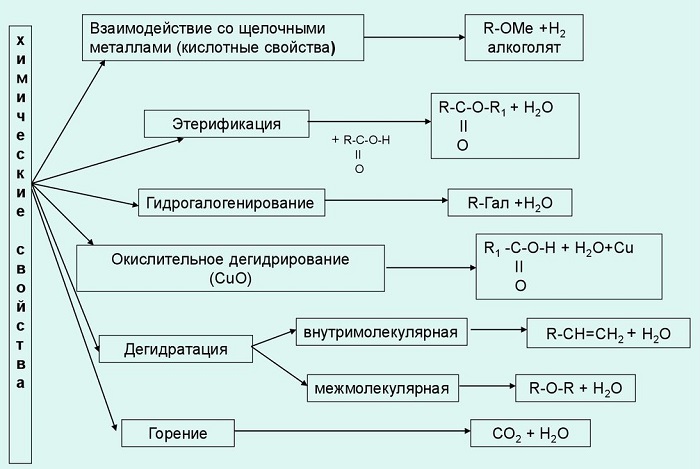
Химические свойства спиртов
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Предельные одноатомные спирты можно распознать с помощью
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Спирты классифицируют по различным структурным признакам.
1. По числу гидроксильных групп спирты подразделяются на
двухатомный спирт – этиленгликоль (этандиол)
трехатомный спирт – глицерин (пропантриол-1,2,3)
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
2. В зависимости от того, с каким атомом углерода ( первичным, вторичным или третичным ) связана гидроксигруппа, различают спирты
3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O
Предельные одноатомные спирты
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (- OH )
2. Гомологический ряд
Метиловый спирт
(метанол)
3. Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса «ол».
По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова «спирт«. В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
Для спиртов характерна структурная изомерия:
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3 C H(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более «кислым» в ряду одноатомных предельных спиртов будет метиловый (метанол).
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
Одноатомные спирты (алкоголи) – это производные алканов, молекула которых имеет одну функциональную гидроксильную группу. Она связана с насыщенным атомом углерода.
В учебниках химии можно встретить определение спиртов – это обширный класс химических соединений, выполняющих важнейшие функции в живых организмах. Рассматриваемые вещества широко применяются в промышленном производстве и повседневной жизни.
Описание и общая формула одноатомных спиртов
В таких спиртах атом водорода замещается гидроксильной группой ОН. Они имеют формулу CnH2n+1OH.
В современной номенклатуре их названия связаны с гомологическим рядом предельных алканов с суффиксом –ол (этанол, пропанол, бутанол, пропанол, гексанол и проч).
В зависимости от размещения группы ОН, существует классификация алкоголей:
первичные –группа ОН присоединена к первому атому С;
вторичные – гидроксильная группа присоединена ко второму атому этого элемента;
третичные – группа ОН присоединена к третьему атому углерода.
Изомерия одноатомных спиртов
Для этих веществ характерны разные виды изомерии:
Структурная – изменение расположения ОН начиная с соединений, содержащих 3 атома углерода. Так, существует пропанол 1 (н-пропиловый) и пропанол-2 (изопропиловый).
Изомерия углеродного звена – изменение положения гидроксильной группы, начиная с веществ, молекула которых содержит 4 углеродных атома. Так, бутанолу соответствует четыре разных изомера.
Межклассовая изомерия (с эфирами). Этиловому алкоголю с формулой СН3CH2–OH соответствует диметиловый эфир CH3–O–CH3.
Пространственная, или зеркальная изомерия.
Физические свойства
Вещества с количеством атомов углерода до 15 являются летучими жидкостями с резким запахом. Соединения с числом атомов углерода свыше 15 являются твердыми веществами.
Начальный член гомологического ряда (метанол) чрезвычайно токсичен для человека.
Чем выше спирт, тем и выше его температура кипения. Различия между каждым членом гомологического ряда составляет примерно 20 градусов. По мере увеличения размера молекулы и ее массы снижается и их воспламеняемость. Следовательно, легче всех воспламеняется метанол.
Соединения, имеющие в составе молекулы 9 атомов углерода, растворяются в воде (метанол и этанол – в каком угодно соотношении). Хорошо растворяются в растворителях.
Химические свойства
Рассматриваемые вещества ведут себя и как основания, и как кислоты.
Основные химические свойства одноатомных спиртов:
Взаимодействие с щелочными металлами. При этом образуются алкоголяты или алкоксиды. В воде эти вещества подвергаются гидролизу, образуя спирт и основание.
Реакция с хлористым тионилом дает в итоге галогеналкан.
В результате внутримолекулярного обезвоживания получают алкены.
При межмолекулярной дегидратации образуются простые эфиры.
Химическая реакция одноатомного алкоголя с перманганатом калия дает альдегид. Дальнейшим окислением альдегида можно получить одноатомную карбоновую кислоту.
Получение
Известно несколько методов получения простых спиртов:
1. Гидратация алкенов (с присоединением молекулы воды):
2. Гидролиз алкилгалогенидов (с добавлением водных растворов щелочей):
3. Восстановление кетонов:
4. Этанол получают путем разложения глюкозы:
5. Восстановление карбоновых кислот и сложных эфиров.
6. Присоединение металлорганических химических соединений к кетонам и альдегидам.
Применение одноатомных спиртов
Одноатомные спирты широко применяются как исходный реагент для получения альдегидов, кетонов, карбоновых кислот и эфиров. Все эти вещества широко применяются в производстве и быту.
Вот примеры использования наиболее распространенных спиртов:
Метанол является прекрасным органическим растворителем. Его применяют в производстве лаков и красок, органических смол.
Этанол широко используется в медицине как антисептик и растворитель. В пищевой промышленности его используют для получения алкогольных напитков. Он является основой для получения сложных эфиров, уксуса.
Бутанол применяется как растворитель и основа для получения веществ с приятным ароматом.
Бензиловый спирт является основой для получения душистых веществ.
Рассмотренные в статье вещества имеют широкое применение в промышленности. Без них невозможно получение многих веществ, использующихся в быту.