Правильный рецепт на феназепам
Феназепам
Аналоги (дженерики, синонимы)
Действующее вещество
Фармакологическая группа
Рецепт
Международный:
Rp.: Phenazepami 0,001
D.t.d. № 50 in tab.
S. По 1 таблетке на ночь
Россия:
S. По 1мл 2 раза в день, внутримышечно
Рецептурный бланк 148-1/у-88
Фармакологическое действие
Анксиолитическое средство (транквилизатор) бензодиазепинового ряда. Оказывает анксиолитическое, седативно-снотворное, противосудорожное и центральное миорелаксирующее действие.
Усиливает ингибирующее действие ГАМК на передачу нервных импульсов. Стимулирует бензодиазепиновые рецепторы, расположенные в аллостерическом центре постсинаптических ГАМК-рецепторов восходящей активирующей ретикулярной формации ствола мозга; уменьшает возбудимость подкорковых структур головного мозга (лимбическая система, таламус, гипоталамус), тормозит полисинаптические спинальные рефлексы.
Анксиолитическое действие обусловлено влиянием на миндалевидный комплекс лимбической системы и проявляется в уменьшении эмоционального напряжения, ослаблении тревоги, страха, беспокойства.
Седативный эффект обусловлен влиянием на ретикулярную формацию ствола головного мозга и неспецифические ядра таламуса и проявляется уменьшением симптоматики невротического происхождения.
На продуктивную симптоматику психотического генеза (острые бредовые, галлюцинаторные, аффективные расстройства) практически не влияет, редко наблюдается уменьшение аффективной напряженности, бредовых расстройств.
Снотворное действие сопряжено с угнетением клеток ретикулярной формации ствола головного мозга. Уменьшает действие эмоциональных, вегетативных и моторных раздражителей, нарушающих механизм засыпания.
Противосудорожное действие реализуется путем усиления пресинаптического торможения, подавляет распространение судорожного импульса, но не устраняет возбужденное состояние очага.
Центральное миорелаксирующее действие обусловлено торможением полисинаптических спинальных афферентных тормозящих путей (в меньшей степени — и моносинаптических). Возможно и прямое торможение двигательных нервов и функции мышц.
Способ применения
Для взрослых:
Препарат следует принимать внутрь. Разовая доза обычно составляет 0.5-1 мг.
При невротических, психопатических, неврозоподобных и психопатоподобных состояниях начальная доза препарата составляет 0.5-1 мг 2-3 раза/сут. Через 2-4 дня с учетом эффективности и переносимости препарата доза может бьпь увеличена до 4-6 мг/сут.
При выраженной ажитации, страхе, тревоге лечение начинают с дозы 3 мг/сут, быстро увеличивая дозу до получения терапевтического эффекта.
При эпилепсии доза составляет 2-10 мг/сут.
При алкогольной абстиненции Феназепам назначают в дозе 2.5-5 мг/сут.
При заболеваниях с повышенньм мышечным тонусом препарат назначают по 2-3 мг 1-2 раза/сут.
Во избежание развития лекарственной зависимости при курсовом лечении продолжительность применения Феназепама составляет 2 недели. В отдельных случаях длительность лечения может быть увеличена до 2 месяцев. При отмене npenapaтa дозу уменьшают постепенно.
Показания
— невротические, неврозоподобные, психопатические, психопатоподобные и другие состояния, сопровождающиеся тревогой, страхом, повышенной раздражительностью, напряженностью, эмоциональной лабильностью;
— реактивные психозы;
— ипохондрическо-сенестопатический синдром (в т. ч. резистентный к действию других транквилизаторов);
— вегетативные дисфункции;
— расстройства сна;
— профилактика состояний страха и эмоционального напряжения;
— височная и миоклоническая эпилепсия;
— гиперкинезы и тики;
— ригидность мышц;
— вегетативная лабильность.
Противопоказания
— кома;
— шок;
— миастения;
— закрытоугольная глаукома (острый приступ или предрасположенность);
— тяжелая ХОБЛ (возможно усиление дыхательной недостаточности);
— острая дыхательная недостаточность;
— беременность (особенно I триместр);
— период грудного вскармливания;
— детский и подростковый возраст до 18 лет (безопасность и эффективность не определены);
— повышенная чувствительность к бензодиазепинам.
С осторожностью следует применять препарат при печеночной и/или почечной недостаточности, церебральных и спинальных атаксиях, гиперкинезе, склонности к злоупотреблению психотропных препаратов, органических заболеваниях головного мозга (возможны парадоксальные реакции), гипопротеинемии, депрессии, у пациентов пожилого возраста.
Побочные действия
— Со стороны системы кроветворения: лейкопения, нейтропения, агранулоцитоз, анемия, тромбоцитопения.
— Со стороны пищеварительной системы: сухость во рту или слюнотечение, изжога, тошнота, рвота, снижение аппетита, запор или диарея, нарушение функции печени, повышение активности печеночных трансаминаз и ЩФ, желтуха.
— Аллергические реакции: кожная сыпь, зуд.
Форма выпуска
Приказ № 4н о рецептурных бланках 2020-го года: подробный разбор
Обзор вебинара о новых правилах отпуска рецептурных препаратов в 2020 году и порядке назначения и оформления бланков медицинских рецептов — изучаем изменения наглядно
19 апреля на нашем сайте состоялся вебинар, посвященный вступлению в силу новых правил выписывания лекарственных средств. Для тех, кто пропустил трансляцию, мы подготовили обзор главных изменений, которые внес новый приказ в порядок взаимодействия врачей и фармацевтов. Лектор вебинара — к. ф. н., доцент кафедры управления и экономики фармации Северо-Западного государственного медицинского университета (СЗГМУ) им. И. И. Мечникова (г. Санкт-Петербург) Лариса Гарбузова. Она рассказала о нормах приказа Минздрава РФ от 14.01.2019 № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения», вступившего в силу 7 апреля 2019 года.
Приказ
Начнем с самого главного: новый приказ № 4н не несет в себе глобальных изменений по сравнению с приказом Минздрава 1175 н и принципиально не меняет привычную схему взаимодействия врача и фармацевта (провизора). Основные новшества коснулись только порядка назначения лекарственных препаратов, формы бланков рецептов на лекарства и порядка их оформления в 2020 году.
Назначение
Начнем с назначения ЛС. Препараты, как и раньше, назначаются по МНН, а при его отсутствии — по группировочному наименованию. Или же по торговому наименованию, если первые два отсутствуют.
Здесь стоит обратить внимание на то, что информация в Государственном реестре лекарственных средств постоянно обновляется, и некоторые препараты (например, отпуск кодеинсодержащих препаратов) недавно лишились группировочных наименований в регистрационных досье. Таким образом, выписка их по торговому наименованию не является нарушением, даже если на рецепте нет отметки «По решению врачебной комиссии». Поэтому необходимо внимательно проверять то, какие данные о препарате содержатся в ГРЛС.
Изменения приказа коснулись назначения лекарственных препаратов в стационарах. Теперь на них так же распространяется правило назначения только по МНН или группировочному наименованию. Назначить препарат по торговому наименованию в стационаре можно только при их отсутствии. Ранее, напомним, в приказе № 1175н лекарственные препараты в стационарах можно было назначать сразу по ТН.
Бланки
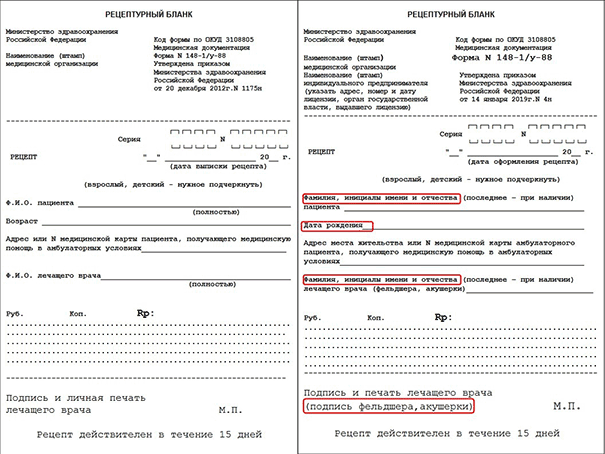
Главное — отменен рецептурный бланк № 148–1/у-06 (л). Все рецепты препаратов, отпускаемые бесплатно или со скидкой, с 2020 года выписываются на бланке нового образца рецепта формы № 148–1/у-04 (л).
Списки препаратов для каждого бланка остались без изменений.
На рецептурном бланке формы № 148–1/у-88 выписываются:
— психотропные ЛП Списка III;
— ЛП, обладающие анаболической активностью, относящиеся по АТХ к анаболическим стероидам (код А14А);
— ЛП, указанные в пункте 5 Приказа Минздрава 562 н от 17.05.2012;
— ЛП индивидуального изготовления, содержащие НС или ПВ Списка II и другие фармакологически активные вещества;
— иные ЛП, подлежащие ПКУ.
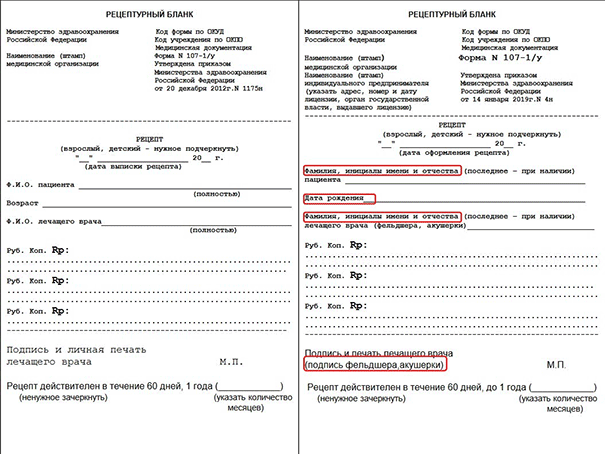
На бланке рецепта формы № 107–1/у выписываются все остальные препараты и ЛС, указанные в п. 4 приказа 562 н Министерства здравоохранения.
Форма рецептурных бланков на 2020 год
Очевидно, что на бланках изменилось наименование приказа, которым они утверждены. Теперь вверху каждого рецепта должно быть указание на приказ Министерства здравоохранения Российской Федерации от 14 января 2019 г. № 4н, а не на 1175н приказ Минздрава, как раньше. Это не касается рецептурного бланка формы N 107/у-НП, поскольку его форма утверждена приказом минздрава 54 н от 01.08.2012 г.
Также поменялись реквизиты. Теперь не надо указывать полностью фамилию, имя и отчество пациента, достаточно только фамилии и инициалов. Это же касается и ФИО врача, назначающего препарат. Кроме того, теперь в рецептах указывается дата рождения, а не возраст больного.
Для наглядности ниже мы приводим сравнение старых и новых образцов бланков, где изменения выделены красным цветом.
Сразу напомним про сроки действия старых рецептурных бланков и старого порядка их заполнения. Если рецепт оформлен до 7 апреля 2019 (до вступления в силу приказа № 4н), то он должен быть выписан в соответствии с приказом МЗ РФ 1175 н. В начале апреля Минздрав выпустил информационное письмо, в котором допустил возможность использования старых бланков до конца 2019 года. Но если рецепт оформлен после 7 апреля, то все реквизиты должны быть заполнены в соответствии с приказом № 4н, даже если бланк старый. Это значит, что вместо возраста надо указывать дату рождения, а в поле «ФИО» писать инициалы.
На рецептах больше не используется формулировка «пациент с хроническим заболеванием». Теперь это «пациент с заболеванием, требующим длительного курса лечения». На рецептах в этом случае ставится отметка «по специальному назначению». Срок действия таких рецептов на лекарства в России составляет до 1 года, при этом на рецепте нужно указать количество месяцев и периодичность отпуска.
Дозировка в рецептах выписывается согласно инструкции по применению препарата. Например, это значит, что количество вещества можно указывать в миллиграммах. Требование об обязательном оформлении твердых и сыпучих фармсубстанций в граммах (миллилитрах/каплях для жидких препаратов) осталось только для выписки препаратов индивидуального изготовления.
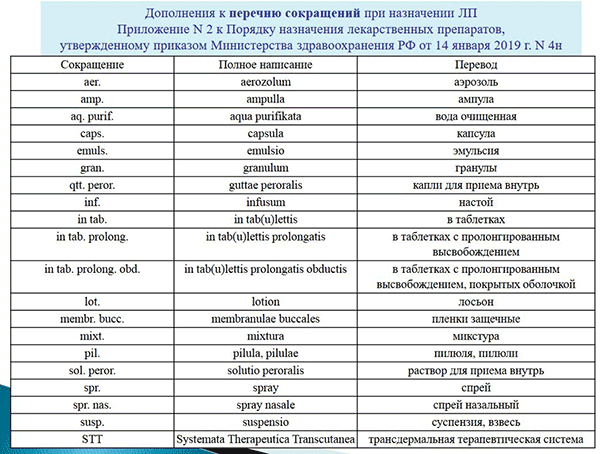
Также расширен список используемых латинских сокращений. В основном за счет введения «новых» (не указанных ранее) лекарственных форм. Например, наконец‑то дистиллированная вода стала простой «водой очищенной». Кроме этого, лекарственную форму в таблетках теперь следует писать как «in tab», а не «in tabl».
Нормы отпуска
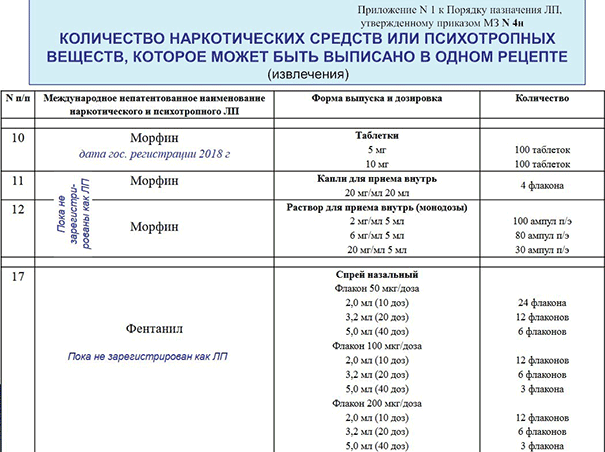
Важным изменением в порядке выписывания лекарственных средств является отмена бывшего Приложения № 2 с «рекомендованным количеством». Сейчас больше нет норм отпуска на комбинированные препараты с кодеином и другим ЛС, которые подлежат ПКУ. Таким образом, эти и другие ЛС (не указанные в Приложении № 1) следует отпускать в тех количествах, в которых они выписаны.
При этом, в приказе остался пункт 25, который полностью повторяет пункт 22 из приказа 1175н МЗ РФ, что рецепты на определенные препараты могут выписываться на курс лечения до 60 дней со специальным оформлением. Однако, в предыдущем приказе указывалось, что в этом случае можно превысить количества, указанные в Приложении № 2. Но теперь нет ссылки на Приложение № 2 и, скорее всего, это значит, речь идет о Приложении № 1.
Кроме этого, в 2020 году на одном рецептурном бланке можно выписывать только одно наименование ЛС, не подлежащего ПКУ и относящегося к:
— антипсихотическим средствам (код N05A по АТХ);
— анксиолитикам (код N05Bпо АТХ);
— снотворным и седативным средствам (код N05C по АТХ);
— и антидепрессантам (код N06Aпо АТХ).
Таким образом решается проблема с исполнением п. 14 правил отпуска (приказ № 403н). Ведь такие рецепты необходимо хранить в аптеке в течение трех месяцев, но раньше на рецепте можно было выписать до трех наименований таких ЛС. И если пациент приобретал только одно, то рецепт надо было оставить в аптеке, а для отпуска двух других препаратов требовалось оформление нового бланка.
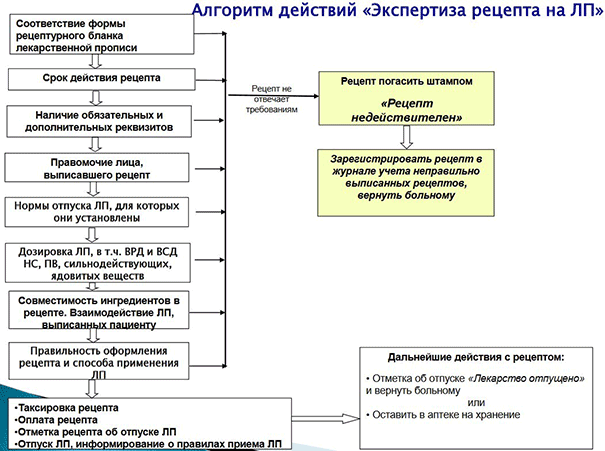
Экспертиза
Алгоритм работы с рецептами в соответствии с новым приказом можно изобразить в виде простой схемы:
Всё также важно проверять сроки действия рецептов — они не изменились в сравнении с приказом № 1175н. Также необходимо внимательно смотреть на обязательные для всех бланков реквизиты. Помните, что имя врача может быть заполнено не только от руки, но и штампом.
По мнению Ларисы Гарбузовой, скорее всего, в первое время после вступления в силу нового приказа будет очень много ошибок в заполнении поля «возраст» и в указании ФИО полностью, без инициалов. Особенно если рецепт будет выписан на старом бланке. Является ли это нарушением, запрещающим отпуск препарата? К сожалению, четкого ответа на этот вопрос нет. Равно как нет и практики привлечения за это к ответственности, поскольку приказ вступил в силу совсем недавно.
Стандартная операционная процедура
Не стоит забывать, что для проведения экспертизы рецептов и правильного отпуска в аптеке необходимо разработать СОП для этих процедур. Пример того, что может быть указано в документе, мы приводим на иллюстрации ниже.
И в заключение нужно сказать, что утверждение нового порядка отпуска неминуемо вызовет изменение других нормативных документов, регламентирующих правила выписывания и оформление рецептов, в будущем. Например, порядка отпуска препаратов (приказ № 403н) — хотя бы потому, что в нем до сих пор присутствует ссылка на старый приказ. Также в приказе № 403н нет порядка отпуска лекарственных средств при помощи электронных рецептов.
Кроме этого, и сам приказ № 4н далеко не идеальный. Всё еще остаются спорные моменты, такие как: присутствие пункта 25 или вопрос о том, является ли нарушением указание на старом бланке возраста вместо даты рождения. Поэтому будем надеяться, что уже в ближайшем будущем Минздрав выпустит письмо с дополнительными разъяснениями или внесет поправки в сам приказ.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Минздрав уточнил дату вступления в законную силу новых правил обращения феназепама
Внесение феназепама в список сильнодействующих веществ для целей статьи 234 и других статей УК РФ вызвало недопонимание у аптек о сроке вступления в силу новых правил его обращения. В частности, аптеки получают комментарии юристов о том, что новые правила обращения препарата начнут действовать с 1 сентября 2021 года. Это мнение ошибочно. Минздрав в связи с многочисленными обращениями дал свои разъяснения.
Министерство здравоохранения РФ выпустило информационное письмо для руководителей регионов в сфере здравоохранения с разъяснением правил обращения и хранения препаратов «Бромдигидрохлорфенилбензодиазепин» (торговые наименования «Феназепам», «Элзепам», «Феназептин», «Фезанеф», «Фенорелаксан», «Транквезипам»). Копия письма имеется в распоряжении «ФВ».
Почему возникли разночтения
С 22 марта феназепам (фензитат, фезипам, феназептин, элзепам и т.д.) подлежит предметно-количественному учету (утверждено постановлением Правительства № 1495 от 18 сентября 2020 года). Изменения были внесены в Раздел II номенклатуры сильнодействующих и ядовитых веществ, не являющихся прекурсорами наркотических средств и психотропных веществ, а также в список сильнодействующих веществ для целей статьи 234 УК РФ.
Новое правило обращения препарата включает в себя требование его выписки на бланке 148-1/у-88.
Кроме того, после отпуска лекарства фармацевтический работник должен забрать у пациента такой рецепт и хранить его в аптеке три года. Все операции (приход, расход) регистрируются в специальном журнале, который оформляется на календарный год.
Минздравом разработан новый приказ «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учету». Он должен прийти на смену действующему сейчас приказу №183Н. В ближайшее время этот документ будет направлен в Минюст России. Указанный срок вступления его в силу — с 1 сентября 2021 года.
Этот факт вызывает сомнения у аптек в необходимости применять новые требования по обращению феназепама с 22 марта 2021 года. Однако Минздрав разъясняет, что такое мнение ошибочно. Аптеки не должны дожидаться 1 сентября.
«Учитывая, что в иерархии нормативных правовых актов акт Правительства РФ выше акта Минздрава России, необходимо обеспечить ведение предметно-количественного учета лекарственных препаратов, содержащих «Бромдигидрохлорфенилбензодиазепин», а также их отпуск по рецептам, оформленным на рецептурных бланках формы 148-1/у-88, до вступления в силу приказа», — указано в информационном письме Минздрава.
Как хранить феназепам
Как рассказала «ФВ» исполнительный директор Нацфармпалаты Елена Неволина, «Бромдигидрохлорфенилбензодиазепин» — первый в России препарат, который попал под правила международного контроля.
В своем информационном письме Минздрав дает подробное разъяснение правил хранения препарата. В частности, в нем указано, что лекарственные средства, включенные в список сильнодействующих веществ, подлежат обязательному включению в перечень лекарств, подлежащих предметно-количественному учету (перечень ПКУ).
Согласно правилам хранения лекарственных препаратов (утверждены приказами Минздравсоцразвития России №706Н, Минздрава России №646н), установлено, что «хранение сильнодействующих лекарственных средств, находящихся под контролем в соответствии с международными правовыми нормами, осуществляется в помещениях, оборудованных инженерными и техническими средствами охраны, аналогичными предусмотренным для хранения наркотических и психотропных лекарственных средств», — указано в письме ведомства.
«Аптекам стоит обратить пристальное внимание на тот факт, что новые правила обращения этого препарата вступили в силу 22 марта. Опираться на еще не принятый приказ Минздрава и считать, что новые правила обращения феназепама начнут действовать с 1 сентября – ошибочно! При этом, требования по хранению феназепама аналогичны требованиям по хранению наркотических и психотропных препаратов», — пояснила Елена Неволина.
Проходите тесты и опросы, участвуйте в играх — зарабатывайте баллы, становитесь лидерами рейтинга и получайте полезные подарки и признание от Фармкружка!
Предметно-количественный учет феназепама в 2021 году
Последняя неделя у аптечных работников прошла под знаком феназепама.
Вместе с этим, указанные в письме МЗ требования по хранению стали неожиданным сюрпризом для аптек. Согласно письму бромдигидрохлорфенилбензодиазепин включен в Список IV Конвенции ООН о психотропных веществах 1971 года, а значит он находится под международным контролем и, следовательно, должен храниться в помещениях, оборудованных специальными инженерными и техническими средствами охраны, необходимыми для хранения наркотических и психотропных ЛС.
Согласно выше перечисленному бромдигидрохлорфенилбензодиазепин с 22.03.21:
1.Выписывается на бланке 148-1/у-88
2.После отпуска рецепты остаются в аптеке
3.Срок хранения рецептов составляет 3 года
Дорожная карта
Четвертый пункт стал самым невыполнимым т.к. очень небольшое количество аптек смогут обеспечить необходимые требования:
Согласно Постановлению Правительства РФ от 31.12.2009 N 1148 (ред. от 19.10.2020) «О порядке хранения наркотических средств, психотропных веществ и их прекурсоров» аптечные организации относятся ко второй категории, а значит охрана аптек должна осуществляться на договорной основе подразделениями войск национальной гвардии Российской Федерации, или организацией, подведомственной Федеральной службе войск национальной гвардии Российской Федерации, или ведомственной охраной федеральных органов исполнительной власти и организаций, в ведении которых находятся указанные помещения.
Уровень инженерно-технической оснащенности помещений, виды технических средств охраны и класс устойчивости сейфов к взлому определяются при заключении договора с охранной организацией.
Главный вопрос
Аптеки, которые еще до 22 марта 2021 года вывели феназепам из ассортимента могут жить спокойно. Те же аптеки, которые планировали оставить его в ассортименте, но не знали, что он подлежит международному контролю, сейчас в очень незавидном положении, ведь по сути они нарушают условия хранения, а это лицензионное требование. Основной вопрос этих аптек «что делать с остатками препарата?» пока остается без ответа т.к. вернуть упаковки поставщику нельзя (без оснований никто из поставщиков просто не заберет товар), списать тоже оснований нет, а хранить мы не можем.
Будем надеяться, что в ближайшее время ведомство опубликует дополнительные разъяснения. В какой ситуации находится ваша аптека?
Отвечаем на вопросы в прямых эфирах Вконтакте: https://vk.com/pharmznanie
Обсудить последние новости со всеми коллегами России вы можете в чатах:
И вновь «Феназепам»
С 22 марта 2021 года вступили в силу изменения в Постановление Правительства РФ № 1495 от 18.09.2020 «О внесении изменений в некоторые акты Правительства Российской Федерации», в соответствии с которыми список сильнодействующих веществ для целей ст. 234 и других статей Уголовного кодекса РФ дополнен позицией «Бромдигидрохлорфенилбензодиазепин (7-бромо-5-(2-хлорфенил)-1,3-дигидро-2Н-1,4-бензодиазепин-2-он)». На территории России это вещество входит в состав препаратов с торговыми наименованиями «Феназепам», «Элзепам», «Феназептин», «Фезанеф», «Фенорелаксан», «Транквезипам». На самые частые вопросы аптечных работников, которые поступили в «ФВ», отвечают партнер Адвокатского бюро «Ольга Ренова и партнеры» Ольга КАРПОВА и исполнительный директор Национальной фармацевтической палаты Елена НЕВОЛИНА.
Как хранить «Феназепам»?
Бромдигидрохлорфенилбензодиазепина пока нет в перечне лекарств, подлежащих предметно-количественному учету (ПКУ). Его Минздрав планирует обновить только с 1 сентября. Несмотря на данное обстоятельство, препараты, содержащие это вещество, с 22 марта 2021 года в обязательном порядке необходимо хранить в изолированных помещениях, специально оборудованных инженерными и техническими средствами охраны, и в местах временного хранения при соблюдении требований, установленных Правилами хранения наркотических средств и психотропных веществ (п. 67 Приказа Минздравсоцразвития РФ № 706н от 23.08.2010 «Об утверждении Правил хранения лекарственных средств» и Постановление Правительства РФ № 1148 от 31.12.2009).
Медорганизации и аптеки обязаны вести предметно-количественный учет лекарств, которые содержат бромдигидрохлорфенилбензодиазепин.
Такие обязанности возникают в связи с тем, что препарат внесен в перечень сильнодействующих веществ постановлением Правительства РФ, обладающим большей юридической силой по отношению к приказам Министерства здравоохранения.
Что с ним делать, если у аптеки нет лицензии на оборот наркотических и психотропных веществ?
Бромдигидрохлорфенилбензодиазепин отнесен только к перечню сильнодействующих препаратов, но не к наркотическим или психотропным препаратам. Это означает, что на него не распространяются правила отпуска, установленные:
Аптеки вправе реализовывать препарат в отсутствие лицензии на отпуск наркотических и психотропных веществ.
Однако нельзя исключать, что могут возникнуть и спорные ситуации. Ведь в соответствии с резолюцией № 59/7, принятой на 59-й сессии Комиссии ООН по наркотическим средствам в марте 2016 года, в Список IV Конвенции ООН о психотропных веществах 1971 года включено вещество с химическим названием 7-бромо-5-(2-хлорфенил)-1,3-дигидро-2Н-1,4-бензодиазепин-2-он. Это означает, что бромдигидрохлорфенилбензодиазепин с точки зрения норм международного права является психотропным веществом. Нельзя исключать, что некоторые правоохранители могут начать применять нормы Конвенции 1971 года напрямую. Но такая позиция будет являться неправомерной, и у аптек есть все шансы защитить свои права.
Комментирует Елена Неволина:
«Бромдигидрохлорфенилбензодиазепин действительно отнесен только к перечню сильнодействующих препаратов, но не к наркотическим или психотропным препаратам. И значит, аптеки, не имеющие лицензии на отпуск наркотических и психотропных веществ, могут его продавать.
Однако прошу обратить внимание на то, что храниться в аптеке он должен при соблюдении требований, установленных Правилами хранения наркотических средств и психотропных веществ: в изолированных помещениях, специально оборудованных инженерными и техническими средствами охраны.
Есть ли у аптек такие помещения, если нет лицензии на отпуск таких средств, — большой вопрос».
Если рецепт на препарат выписан до 22 марта, как быть с отпуском по нему? Нельзя или можно отпускать?
С 22 марта отпускать препараты, содержащие бромдигидрохлорфенилбензодиазепин, можно только по рецептам на бланках формы № 148-1/у-88. Отпускать препарат по рецептам иной формы, оформленным до 22 марта, нельзя. Это приведет к нарушению порядка отпуска препарата и риску привлечения аптеки и должностных лиц к административной и даже уголовной ответственности.
Где сказано, что «Феназепам» находится под международным контролем?
Не сам «Феназепам», но его действующее вещество бромдигидрохлорфенилбензодиазепин подлежит международному контролю.
В соответствии с резолюцией № 59/7, принятой на 59-й сессии Комиссии ООН по наркотическим средствам в марте 2016 года, в Список IV Конвенции ООН о психотропных веществах 1971 года включено вещество с химическим названием 7-бромо-5-(2-хлорфенил)-1,3-дигидро-2Н-1,4-бензодиазепин-2-он.
Комментирует Елена Неволина:
«Изначально именно препарат «Феназепам» попал под международный контроль. В 2016 году он был внесен в Список IV Конвенции ООН о психотропных веществах 1971 года. Однако Минздрав обратил внимание, что возникло некое недоразумение, потому что остальные препараты, содержащие бромдигидрохлорфенилбензодиазепин, в список включены не были. Произошло это чуть позднее, после обращения ведомства с просьбой дополнить документ и внести туда вещество с химическим названием 7-бромо-5-(2-хлорфенил)-1,3-дигидро-2Н-1,4-бензодиазепин-2-он».